ملخص المحتوى
ملخص الفصل الأول من كتاب الكيمياء Chemistry (الأفكار والمفاهيم الأساسية) المقرر في الجامعات الأمريكية والأوروبية، الكيمياء في السياق: التطور التاريخي للكيمياء، أهمية الكيمياء في الحياة اليومية، مفهوم الطريقة العلمية، الفرضيات والنظريات والقوانين، النطاقات العينية والمجهرية والرمزية في الكيمياء. مراحل وتصنيف المادة: الخصائص الأساسية لحالات المادة الصلبة والسائلة والغازية، الذرات والجزيئات، تصنيفات المادة كعنصر أو مركب أو خليط متجانس أو خليط غير متجانس فيما يتعلق بحالتها المادية وتكوينها، الكتلة والوزن، قانون حفظ المادة.
الأفكار والمفاهيم الأساسية في الكيمياء
مخطط الفصل:
- 1.1 الكيمياء في السياق
- 1.2 مراحل وتصنيفات المادة
- 1.3 الخصائص الفيزيائية والكيميائية
- 1.4 القياس في الكيمياء
- 1.5 عدم اليقين والدقة والضبط في القياس
- 1.6 تحويل الوحدات والمعالجة الرياضية لنتائج القياس
مدخل إلى دراسة الكيمياء
ينفجر المنبه الخاص بك، وبعد ضربه “غفوة” مرة أو مرتين، أنت تخرج من السرير. يمكنك صنع فنجان من القهوة لمساعدتك على الاستمرار، ثم تستحم، وترتدي ملابس وتتناول وجبة الإفطار، وتتحقق من هاتفك للحصول على الرسائل. في طريقك إلى المدرسة، تتوقف من أجل ملء خزان الغاز في سيارتك، مما يجعلك متأخرًا لليوم الأول من فصل الكيمياء. عندما تجد مقعدًا في الفصل الدراسي، تقرأ السؤال المتوقع على الشاشة: “مرحبًا بك في الفصل! لماذا يجب أن ندرس الكيمياء؟”
هل لديك إجابة؟ قد تدرس الكيمياء لأنها تفي بمتطلبات أكاديمية، ولكن إذا كنت تفكر في أنشطتك اليومية، فقد تجد الكيمياء مثيرة للاهتمام لأسباب أخرى. معظم ما تفعله وتواجهه خلال يومك ينطوي على الكيمياء. صنع القهوة، وطهي البيض، والخبز المحمص يشمل الكيمياء.
المنتجات التي تستخدمها – مثل الصابون والشامبو، والأقمشة التي ترتديها، والإلكترونيات التي تبقيك متصلاً بعالمك، والبنزين الذي يدفع سيارتك – كلها تتضمن مواد وعمليات كيميائية. سواء كنت على دراية أم لا، فإن الكيمياء جزء من عالمك اليومي. في هذه الدورة، سوف تتعلم العديد من المبادئ الأساسية الكامنة وراء كيمياء الحياة الحديثة.

الشكل 1.1 المواد الكيميائية والعمليات ضرورية لوجودنا، وتوفير الغذاء، والحفاظ على النظافة والصحة، وتصنيع الأجهزة الإلكترونية، وتمكين النقل، وأكثر من ذلك بكثير.
المحتويات
1.1 الكيمياء في السياق
بحلول نهاية هذا القسم، ستتمكن من:
- تحديد التطور التاريخي للكيمياء
- تقديم أمثلة على أهمية الكيمياء في الحياة اليومية
- وصف الطريقة العلمية
- التفريق بين الفرضيات والنظريات والقوانين
- تقديم أمثلة توضح النطاقات العينية والمجهرية والرمزية
على مدار تاريخ البشرية، حاول الناس تحويل المادة إلى أشكال أكثر فائدة. قام أسلافنا الحجريين بقطع قطع من الصوّان في أدوات مفيدة وخشب منحوت في التماثيل والألعاب. تضمنت هذه المساعي تغيير شكل المادة دون تغيير المادة نفسها. ولكن مع زيادة معرفتنا، بدأ البشر في تغيير تكوين المواد أيضًا – تم تحويل الطين إلى فخار، وتم علاج الجلود لصنع الملابس، وتم تحويل الخامات النحاسية إلى أدوات ونحاس وأسلحة، وتم تحويل الحبوب إلى الخبز.
بداية التطوير التاريخي للكيمياء
بدأ البشر في ممارسة الكيمياء عندما تعلموا السيطرة على النار واستخدامها للطهي وصنع الفخار وصهر المعادن. بعد ذلك، بدأوا في فصل واستخدام مكوّنات محددة للمادة. تم عزل مجموعة متنوعة من الأدوية مثل الصبار والمر والأفيون من النباتات. تم استخراج الأصباغ، مثل النيلي والأرجواني من المواد النباتية والحيوانية. وتم دمج المعادن لتشكيل السبائك – على سبيل المثال، تم خلط النحاس والقصدير معًا لصنع النحاس – وأنتجت تقنيات الصهر الأكثر تفصيلاً الحديد. تم استخلاص القلويات من الرماد، وتم تحضير الصابون بدمج هذه القلويات مع الدهون. تم إنتاج الكحول عن طريق التخمير وتنقيته بالتقطير.
تمتد محاولات فهم سلوك المادة لأكثر من 2500 عام. في وقت مبكر من القرن السادس قبل الميلاد، ناقش الفلاسفة اليونانيون نظامًا كان فيه المياه أساس كل شيء. ربما تكون قد سمعت عن الافتراض اليوناني الذي يقول أن المادة تتكون من أربعة عناصر: الأرض والهواء والنار والماء. بعد ذلك، انتشرت مزيج من التقنيات الكيميائية والتكهنات الفلسفية من مصر والصين وشرق البحر الأبيض المتوسط من قبل الخيميائيين، الذين سعوا إلى تحويل “المعادن الأساسية” مثل الرصاص إلى “المعادن النبيلة” مثل الذهب، وإنشاء أكسيرات لعلاج الأمراض وتمديد الحياة (الشكل 1.2).

الشكل 1.2 يوضح هذا الشكل ورشة خيميائية في حوالي عام 1580. على الرغم من أن الخيمياء قدمت بعض المساهمات المفيدة في كيفية التلاعب بالمادة، إلا أنها لم تكن علمية بالمعايير الحديثة. (المصدر: مؤسسة التراث الكيميائي).
من الخيمياء جاء التقدم التاريخي الذي أدت إلى الكيمياء الحديثة: عزل الأدوية عن المصادر الطبيعية، والمعادن، وصناعة الصبغة. اليوم، تستمر الكيمياء في تعميق فهمنا وتحسين قدرتنا على تسخير سلوك المادة والسيطرة على المادة. لقد كان هذا الجهد ناجحًا للغاية لدرجة أن العديد من الأشخاص لا يدركون ما هو الموقف الرئيسي للكيمياء بين العلوم أو أهمية الكيمياء وعالميها في الحياة اليومية.
الكيمياء هي العلوم المركزية
يشار إلى الكيمياء في بعض الأحيان باسم “العلوم المركزية” بسبب ترابطها مع مجموعة واسعة من تخصصات STEM الأخرى (STEM تعني مجالات الدراسة في مجالات العلوم والتكنولوجيا والهندسة والرياضيات).
تلعب الكيمياء ولغة الكيميائيين أدوارًا حيوية في علم الأحياء، والطب، وعلوم المواد، والطب الشرعي، والعلوم البيئية، والعديد من المجالات الأخرى (الشكل 1.3). تُعد المبادئ الأساسية للفيزياء ضرورية لفهم العديد من جوانب الكيمياء، وهناك تداخل واسع النطاق بين العديد من التخصصات الفرعية داخل الحقلين، مثل الفيزياء الكيميائية والكيمياء النووية. توفر الرياضيات وعلوم الكمبيوتر ونظرية المعلومات أدوات مهمة تساعدنا على حساب وتفسير ووصف العالم الكيميائي وجعله أكثر وضوحًا بشكل عام.
تتلاقى البيولوجيا والكيمياء في الكيمياء الحيوية، وهو أمر بالغ الأهمية لفهم العديد من العوامل والعمليات المعقدة التي تبقي الكائنات الحية (مثلنا) حية. تجمع الهندسة الكيميائية وعلوم المواد وتكنولوجيا النانو بين المبادئ الكيميائية والنتائج التجريبية لإنتاج مواد مفيدة، تتراوح من البنزين إلى الأقمشة إلى الإلكترونيات. الزراعة وعلوم الأغذية والعلوم البيطرية وصناعة الخميرة والكحوليات والمساعدة في توفير الغذاء في شكل طعام وشراب لسكان العالم. الطب، علم الصيدلة، التكنولوجيا الحيوية، وعلم النبات يحدد ويقوم بإنتاج المواد التي تساعدنا على الحفاظ على صحتنا. تتضمن العلوم البيئية والجيولوجيا وعلوم المحيطات والعلوم الجوية العديد من الأفكار الكيميائية لمساعدتنا على فهم عالمنا البدني وحمايتنا بشكل أفضل. تُستخدم الأفكار الكيميائية للمساعدة في فهم الكون في علم الفلك وعلم الكونيات.
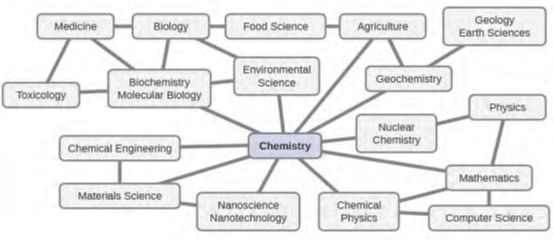
الشكل 1.3: معرفة الكيمياء أمر أساسي لفهم مجموعة واسعة من التخصصات العلمية. يوضح هذا الرسم التخطيطي بعض العلاقات المتبادلة بين الكيمياء والمجالات الأخرى.
أهمية الكيمياء في الحياة اليومية
ما هي بعض التغييرات في المادة الضرورية للحياة اليومية؟ إن هضم واستيعاب الطعام، وتوليف البوليمرات المستخدمة لصنع الملابس والحاويات وأدوات الطهي وبطاقات الائتمان، وتكرير النفط الخام إلى البنزين، والمنتجات الأخرى هي مجرد أمثلة قليلة. أثناء متابعة هذا المقرر، سوف تكتشف العديد من الأمثلة المختلفة للتغييرات في تكوين وهيكل المادة، وكيفية تصنيف هذه التغييرات وكيفية حدوثها، وأسبابها، والتغييرات في الطاقة التي ترافقها، والمبادئ والقوانين المعنية. عندما تتعلم عن هذه الأشياء، ستتعلم كيمياء المادة ودراسة تكوين وخصائص وتفاعلات المادة. لا تقتصر ممارسة الكيمياء على كتب الكيمياء أو المختبرات: يحدث ذلك كلما شارك شخص ما في التغييرات في المادة أو في الظروف التي قد تؤدي إلى مثل هذه التغييرات.
الطريقة العلمية
الكيمياء هي علم يعتمد على الملاحظة والتجريب. يتضمن عمل الكيمياء محاولة الإجابة على الأسئلة وشرح الملاحظات من حيث قوانين ونظريات الكيمياء، وذلك باستخدام الإجراءات المقبولة من قبل المجتمع العلمي. لا يوجد طريق واحد للإجابة على سؤال أو شرح ملاحظة، ولكن هناك جانب شائع في كل نهج: كل منهما يستخدم المعرفة القائمة على التجارب التي يمكن استنساخها للتحقق من النتائج. تتضمن بعض الطرق “الفرضية” Hypothesis، وتفسير مؤقت للملاحظات Observations التي تعمل كدليل لجمع المعلومات والتحقق منها. نختبر الفرضية عن طريق التجريب والحساب و/أو المقارنة مع تجارب الآخرين ثم صقلها حسب الحاجة.
بعض الفرضيات في البحث العلمي هي محاولات لشرح السلوك الذي تم تلخيصه في القوانين Laws. تلخّص قوانين العلوم عددًا كبيرًا من الملاحظات التجريبية، وتصف أو تتنبأ ببعض جوانب العالم الطبيعي. إذا تبين أن مثل هذه الفرضية قادرة على شرح مجموعة كبيرة من البيانات التجريبية، فيمكن أن تصل إلى حالة “النظرية” Theory. النظريات العلمية هي تفسيرات شاملة وقابلة للاختبار لجوانب معينة من الطبيعة.
- يمكن قراءة موضوع متخصص حول: الفرضيات في البحث العلمي
يتم قبول النظريات لأنها توفر تفسيرات مرضية، ولكن يمكن تعديلها في حالة توفر بيانات جديدة. يسمى طريق الاكتشاف الذي يؤدي من السؤال والملاحظة إلى القانون أو الفرضية إلى النظرية، إلى جانب التحقق التجريبي للفرضية وأي تعديل ضروري للنظرية، يسمى باسم “الطريقة العلمية” Scientific Method (الشكل 1.4).
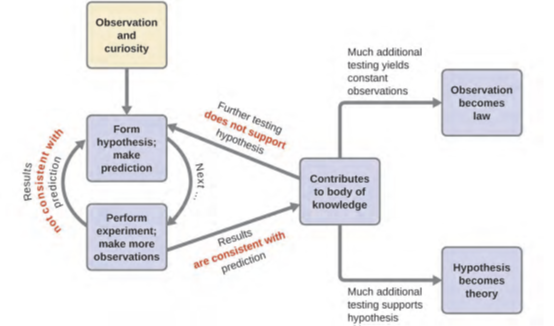
الشكل 1.4: تتبع الطريقة العلمية عملية مماثلة لتلك الموضحة في هذا الرسم التخطيطي. يتم عرض جميع المكونات الرئيسية، بالترتيب الصحيح تقريبًا. نادرًا ما يكون التقدم العلمي أنيقًا ونظيفًا: إنه يتطلب استفسارًا مفتوحًا وإعادة صياغة الأسئلة والأفكار استجابةً للنتائج.
نطاقات الكيمياء الثلاثة
يدرس الكيميائيون ويصفون سلوك المادة والطاقة في ثلاثة نطاقات مختلفة: العينية Macro، المجهرية Micro، والرمزية Symbolic. توفر هذه النطاقات طرقًا مختلفة للنظر في السلوك الكيميائي ووصفه.
1. النطاق العيني أو الماكرو
الماكرو Macro هي كلمة يونانية تعني “كبير”. النطاق العيني مألوف بالنسبة لنا: إنه عالم الأشياء اليومية التي تكون كبيرة بما يكفي ليتم استشعارها مباشرة عن طريق البصر البشري أو اللمس. في الحياة اليومية، يشمل ذلك الطعام الذي تتناوله والنسيم الذي تشعر به على وجهك. يشمل النطاق العيني الكيمياء اليومية والمختبرية، حيث نلاحظ ونقيس الخواص الفيزيائية والكيميائية، أو التغييرات مثل الكثافة، والذوبان، وقابلية الاشتعال بالعين المجرّدة.
2. النطاق المجهري أو المايكرو
يتم دائمًا زيارة النطاق المجهري للكيمياء تقريبًا في الخيال. تأتي كلمة مايكرو Micro أيضًا من اليونانية وتعني “صغير”. يمكن ملاحظة بعض جوانب النطاقات المجهرية من خلال المجهر Microscope، مثل صورة مكبرة من الجرافيت أو البكتيريا. الفيروسات، على سبيل المثال، صغيرة جدًا بحيث لا يمكن رؤيتها بالعين المجردة، ولكن عندما نعاني من نزلة برد، فإننا نتذكر مدى واقعها.
ومع ذلك، فإن معظم الموضوعات في النطاق المجهري للكيمياء – مثل الذرات والجزيئات – هي صغيرة جدًا بحيث لا يمكن رؤيتها حتى مع المجاهر القياسية وغالبًا ما يجب تصوّرها في العقل. تشمل المكونات الأخرى للمجال المجهري الأيونات والإلكترونات والبروتونات والنيوترونات، والروابط الكيميائية، كل منها صغير جدًا. يتضمن هذا النطاق ذرات المعادن الفردية في سلك، وأيونات تشكل بلورة من الملح، والتغيرات في الجزيئات الفردية التي تؤدي إلى تغيير في اللون، وتحويل جزيئات المغذيات إلى الأنسجة والطاقة، وتطور الحرارة كروابط تحمل الذرات معًا.
3. النطاق الرمزي (الرموز)
يحتوي النطاق الرمزي Symbolic على اللغة المتخصصة المستخدمة لتمثيل مكونات النطاقات العينية والمجهرية. تعد الرموز الكيميائية (مثل تلك المستخدمة في الجدول الدوري)، والصيغ الكيميائية، والمعادلات الكيميائية جزءًا من النطاق الرمزي، وكذلك الرسوم البيانية والأشكال. يمكننا أيضًا النظر في الحسابات كجزء من النطاق الرمزي. تلعب هذه الرموز دورًا مهمًا في الكيمياء لأنها تساعد في تفسير سلوك النطاق العيني من حيث مكونات النطاق المجهري. أحد التحديات التي يواجهها الطلاب في تعلّم الكيمياء هو إدراك أن نفس الرموز يمكن أن تمثل أشياء مختلفة في النطاقات العينية والمجهرية، وأحد الميزات التي تجعل الكيمياء رائعة هي استخدام أحد النطاقات التي يجب تخيّلها لشرح السلوك في مجال آخر من النطاقات التي يمكن ملاحظتها.
التمييز بين النطاقات الثلاثة
هناك طريقة مفيدة لفهم النطاقات الثلاثة والفرق بينها وهي عن طريق المادة الأساسية والمتوفرة في كل مكان وهي المياه. هذا الماء هو سائل في درجات حرارة معتدلة، وسوف يتجمد لتشكيل مادة صلبة في درجات حرارة أقل، وعند الغليان يتم تشكيل غاز في درجات حرارة أعلى (الشكل 1.5)، وهذه تقع ضمن الملاحظات العينية. لكن بعض خصائص الماء تقع في النطاق المجهري – وهي التي لا يمكننا ملاحظتها بالعين المجردة. وصف الماء يتألف من ذرتين هيدروجين وذرة أكسجين واحدة، وشرح التجميد والغليان من حيث التجاذب بين هذه الجزيئات، كل ذلك يقع ضمن النطاق المجهري. تُعد الصيغة H2O، التي يمكن أن تصف الماء إما على المستويات العينية أو المجهرية، مثالًا على النطاق الرمزي. الاختصارات (G) للغاز، (S) للصلبة، و (L) للسائل هي أيضًا ضمن النطاق الرمزي.
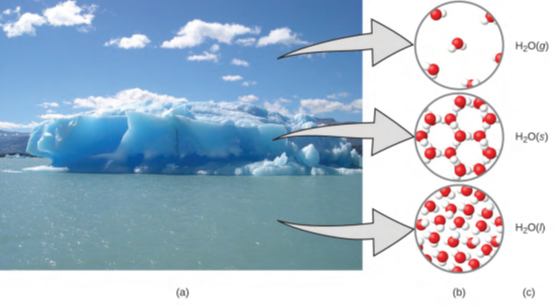
الشكل 1.5 (أ) الرطوبة في الهواء، الجبال الجليدية، والمحيط يمثل الماء في النطاق العيني. (ب) على المستوى الجزيئي (المجهري)، تكون جزيئات الغاز متباعدة وغير منتظمة، وجزيئات المياه الصلبة قريبة من بعضها البعض ومنتظمة، وجزيئات السائل قريبة من بعضها البعض وغير منتظمة. (ج) ترمز الصيغة H2O إلى الماء، والرموز (g)، (s)، و(l) ترمز إلى مراحلها. لاحظ أن الغيوم تتألف فعليًا من قطرات ماء سائل صغير جدًا أو بلورات ماء صلبة؛ الماء الغازي في جونا غير مرئي للعين المجردة، على الرغم من أنه قد يتم استشعاره كرطوبة. (المصدر: Gorkaazk,Wikimedia Commons).
1.2 مراحل وتصنيفات المادة
بحلول نهاية هذا القسم، ستتمكن من:
- وصف الخصائص الأساسية لكل حالة من حالات المادة: الصلبة والسائلة والغازية
- تحديد وإعطاء أمثلة على الذرات والجزيئات
- تصنيف المادة كعنصر أو مركب أو خليط متجانس أو خليط غير متجانس فيما يتعلق بحالتها المادية وتكوينها
- التمييز بين الكتلة والوزن
- فهم وتطبيق قانون حفظ المادة
يتم تعريف المادة Matter على أنها أي شيء يحتل مساحة وله كتلة، وهي متوفرة في شيء من حولنا. من الواضح أن المواد الصلبة والسوائل تعتبر مادة، حيث يمكننا أن نرى أنها تشغل مساحة، ويخبرنا وزنها أن لديهم كتلة. الغازات مادة أيضًا، إذا لم تشغل الغازات أي مساحة، فسيظل البالون كما هو بدلاً من تضخّمه عند ملؤه بالغاز.
حالات المادة
المواد الصلبة والسوائل والغازات هي الحالات الثلاث للمادة عادة على الأرض (الشكل 1.6). المواد الصلبة جامدة بطبيعتها وتمتلك شكلًا محددًا. السائل يتدفق ويأخذ شكل الحاوية التي يكون فيها، باستثناء أنه يشكل سطحًا أو سطح منحني قليلاً عند التأثير عليه بواسطة الجاذبية. (عند الجاذبية الصفر، تفترض السوائل شكلًا كرويًا). كل من العينات السائلة والصلبة لها أحجام مستقلة تقريبًا عن الضغط. يأخذ الغاز كل من شكل وحجم الحاوية التي يكون فيها.
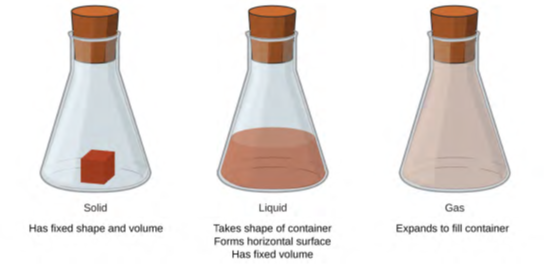
الشكل 1.6: الحالات الثلاث الأكثر شيوعًا أو مراحل المادة الحالة الصلبة والسائلة والغازية.
حالة المادة الرابعة، البلازما Plasma، تحدث بشكل طبيعي في التصميمات الداخلية للنجوم. البلازما هي حالة غازية من المادة التي تحتوي على أعداد ملحوظة من الجزيئات المشحونة كهربائيا (الشكل 1.7). إن وجود هذه الجسيمات المشحونة يضفي خصائص فريدة على البلازما التي تبرر تصنيفها كحالة من المادة متميزة عن الغازات. بالإضافة إلى النجوم، تم العثور على البلازما في بعض البيئات الأخرى ذات درجة الحرارة العالية (الطبيعية والمصنّعة من صنع الإنسان)، مثل ضربات البرق، وشاشات التلفزيون، والأدوات التحليلية المتخصصة المستخدمة لاكتشاف كميات متتبعة من المعادن.

رابط فيديو تعليمي
في خلية صغيرة في تلفزيون البلازما، تبعث البلازما ضوء الأشعة فوق البنفسجية، مما يؤدي بدوره إلى ظهور الشاشة في هذا الموقع بلون محدد. يوضح تركيب هذه النقاط الصغيرة من الألوان الصورة التي تراها.
شاهد هذا الفيديو لمعرفة المزيد عن البلازما والأماكن التي يمكن أن تتواجد فيها:
يبدو أن بعض عينات المادة لها خصائص من المواد الصلبة والسوائل و/أو الغازات في نفس الوقت. يمكن أن يحدث هذا عندما تتكون العينة من العديد من القطع الصغيرة. على سبيل المثال، يمكننا صب الرمال كما لو كان سائلًا لأنه يتكون من العديد من الحبوب الصغيرة من الرمال الصلبة. يمكن أن يكون للمادة أيضًا خصائص لأكثر من حالة واحدة عندما تكون مزيجًا، كما هو الحال مع السحب. يبدو أن الغيوم تتصرف إلى حد ما مثل الغازات، لكنها في الواقع مزيج من الهواء (الغاز) وجزيئات صغيرة من الماء (سائل في حالة المطر أو صلب في حالة الثلوج).
الكتلة والوزن
كتلة الكائن Mass هي مقياس لمقدار المادة فيه. تتمثل إحدى طرق قياس كتلة الكائن في قياس القوة التي تتطلبها عملية تسريع الكائن. يتطلب الأمر المزيد من القوة لتسريع سيارة أكثر من الدراجة لأن السيارة لديها كتلة أكبر بكثير. تتمثل طريقة أكثر شيوعًا لتحديد كتلة الكائن في استخدام ميزان لمقارنة كتلته بكتلة قياسية أخرى.
على الرغم من أن الوزن Weight مرتبط بالكتلة، إلا أنه ليس نفس الشيء. يشير الوزن إلى القوة التي تمارسها الجاذبية على كائن. هذه القوة تتناسب مباشرة مع كتلة الكائن. يتغير وزن الكائن مع تغير قوة الجاذبية، لكن كتلته لا تتغير. لا تتغير كتلة رائدة فضاء لمجرد أنها تذهب إلى القمر. لكن وزنها على سطح القمر هو فقط 1/6 (سُدس) وزنها على سطح الأرض، لأن الجاذبية على سطح القمر ليست سوى سُدس الجاذبية على سطح الأرض. قد تشعر بأنها “بلا وزن” خلال رحلتها عندما تعاني من قوى خارجية ضئيلة (الجاذبية أو أي شيء آخر)، على الرغم من أنها، بالطبع، “لها كتلة ثابتة”.
قانون حفظ المادة
يلخص قانون حفظ المادة Law of conservation of matter العديد من الملاحظات العلمية حول المادة: ينص على أنه لا يوجد تغيير يمكن اكتشافه في الكمية الكلية للمادة الموجودة عندما تتحول المادة من نوع إلى آخر (تغيير كيميائي) أو يتغير بين الحالات الصلبة أو السائلة أو الغازية (تغيير فيزيائي). يقدم تخمير البيرة وتشغيل البطاريات أمثلة على الحفاظ على المادة (الشكل 1.8). أثناء تخمير البيرة، يتم تحويل المكوّنات (الماء، الخميرة، الحبوب، الشعير، والسكر) إلى بيرة (ماء، كحول، كربنة، ومواد نكهة) دون فقدان فعلي للمادة. يظهر هذا بشكل واضح خلال عملية تعبئة الزجاجات، عندما يتحول الجلوكوز إلى الإيثانول وثاني أكسيد الكربون، ولا تتغير الكتلة الكلية للمواد. يمكن ملاحظة ذلك أيضًا في بطارية السيارة (بطارية الحمض والرصاص): حيث يتم تغيير المواد الأصلية (الرصاص، أكسيد الرصاص، وحمض الكبريتيك)، والتي هي قادرة على إنتاج الكهرباء، إلى مواد أخرى (كبريتات الرصاص والماء) التي لا تنتج الكهرباء، مع عدم وجود تغيير في المجموع الفعلي للمادة.
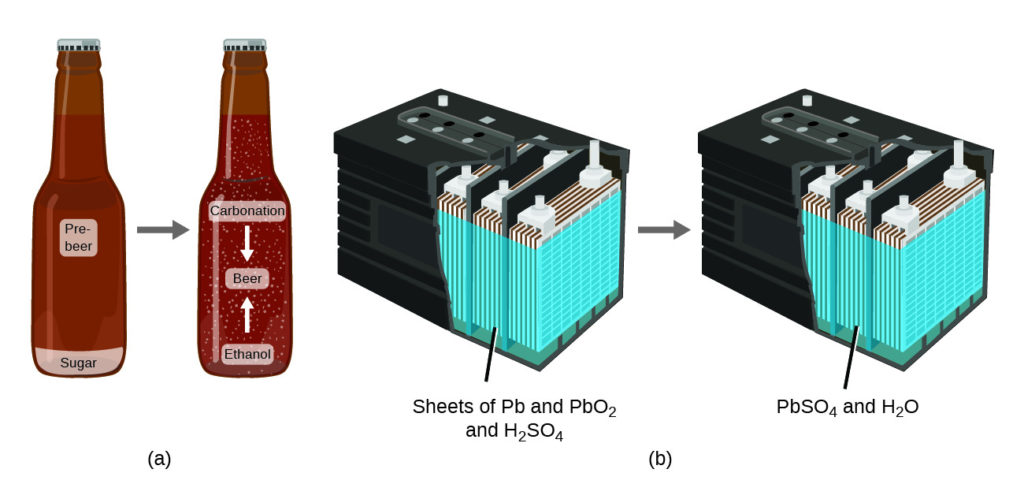
الشكل 1.8: (أ) كتلة المواد المُصنعة للبيرة هي نفس كتلة البيرة المنتجة: أصبح السكر والكحول والكربنة. (ب) كتلة الرصاص، وألواح أكسيد الرصاص، وحمض الكبريتيك الذي يدخل في إنتاج الكهرباء مساوية تمامًا لكتلة كبريتات الرصاص والمياه التي تتشكل.
على الرغم من أن قانون حفظ المادة هذا ينطبق على جميع تحويلات المادة، إلا أن الأمثلة المقنعة قليلة ومتباعدة لأنه خارج الظروف الخاضعة للرقابة في المختبر، نادرًا ما نجمع جميع المواد التي يتم إنتاجها أثناء تحويل معين. على سبيل المثال، عندما تتناول الطعام، وتتم عملية الهضم، واستيعاب الطعام، يتم الحفاظ على كل المادة في الطعام الأصلي. ولكن نظرًا لأن بعض هذه المادة يتم دمجها في جسمك، ويتم إفراز معظمها لأنواع مختلفة من الفضلات، فمن الصعب التحقق من القياس.
الذرات والجزيئات
الذرة هي أصغر جسيم لعنصر له خصائص هذا العنصر ويمكن أن يدخل في مجموعة كيميائية. عند النظر في عنصر الذهب، على سبيل المثال، تخيل قطع كتلة ذهبية إلى نصفين، ثم قطع أحد النصفين إلى النصف، وتكرار هذه العملية حتى ظلت قطعة من الذهب صغيرة لدرجة أنه لا يمكن قطعها إلى نصفين (بغض النظر عن مدى صغر السكين المستخدم). هذه القطعة من الذهب بحجم الحد الأدنى هي ذرة Atom (وهي كلمة مشتقة من كلمة atomos باليونانية، والتي تعني “غير قابل للتجزئة”) (الشكل 1.9). لن تكون هذه الذرة ذهبًا بعد الآن إذا تم تقسيمها إلى أبعد من ذلك.

الشكل 1.9: (أ) تُظهر هذه الصورة كتلة ذهبية. (ب) يمكن لمجهر النفق المسح (STM) إنشاء أشكال لعرض لأسطح المواد الصلبة، مثل هذه الصورة لبلورة ذهبية. يمثل كل شكل ذرة ذهب واحدة. (المصدر: أ. المسح الجيولوجي، الولايات المتحدة؛ ب. Erwinrossen, Wikimedia Commons).
والاقتراح الأول بأن المادة تتكون من الذرات يعزى إلى الفلاسفة اليونانيين لوكيبوس والديمقراطيين، اللذين طوّروا أفكارهم في القرن الخامس قبل الميلاد. ومع ذلك، لم يكن حتى أوائل القرن التاسع عشر إلى أن قام جون دالتون (1766-1844)، وهو مدرس بريطاني له اهتمام شديد بالعلوم، بدعم هذه الفرضية مع القياسات الكمية. منذ ذلك الوقت، أكدت التجارب المتكررة العديد من جوانب هذه الفرضية، وأصبحت واحدة من النظريات المركزية للكيمياء. لا تزال الجوانب الأخرى لنظرية دالتون الذرية تستخدم ولكن مع مراجعات بسيطة (يتم توفير تفاصيل نظرية دالتون في الفصل الخاص بالذرات والجزيئات).
الذرات
الذرة صغيرة جدًا بحيث يصعب تخيّل حجمها. أحد أصغر الأشياء التي يمكن أن نراها مع عيننا المجردة (بغير مساعدة) هي خيط واحد من شبكة العنكبوت: وهذه الخيوط يقدر قطرها بحوالي 1/10،000 من سنتيمتر (0.00001 سم). وعلى الرغم من أن المقطع العرضي لخبط واحد يكاد يكون من المستحيل رؤيته بدون مجهر، إلا أنه ضخم على النطاق الذري. يبلغ قطر ذرة الكربون الواحدة في الشبكة حوالي 0.000000015 سنتيمتر، وسيستغرق الأمر حوالي 7000 من ذرات الكربون لتكوين قطر الخيط نفسه. لتوضيح هذا الأمر، تخيل إذا كانت ذرة الكربون بحجم قطعة نقدية ذات العشرة سنتات، فإن المقطع العرضي لخيط واحد سيكون أكبر من ملعب كرة قدم، والذي يتطلب حوالي 150 مليون “ذرة” من ذرات الكربون لتغطية ذلك. (الشكل 1.10) يوضح اللقطات المجهرية والذرية المكبرة للقطن العادي.
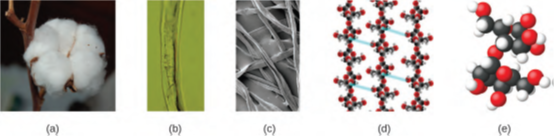
في الشكل 1.10 تظهر لقطات أقرب بشكل متزايد بالترتيب: (أ) نبتة قطن، (ب) ألياف قطنية واحدة يتم عرضها تحت المجهر البصري (مكبر 40 مرة)، (ج) صورة لألياف القطن التي تم الحصول عليها مع مجهر إلكتروني (تكبير أعلى بكثير من المجهر البصري)؛ و(D وE) النماذج ذات المستوى الذري للألياف (تمثل كرات الألوان المختلفة ذرات عناصر مختلفة). (المصدر: Featheredtar, Wikimedia Commons)
الذرة خفيفة لدرجة أنه من الصعب أيضًا تخيل كتلتها. تزن مليار ذرة (1،000،000،000 ذرة) حوالي 3 × 10−13 جرام، وهي كتلة خفيفة للغاية بحيث لا يمكن وزنها حتى على أكثر موازين العالم الأكثر حساسية. سوف يتطلب الأمر أكثر من 300000،000،000،000 ذرة الرصاص (300 تريليون، أو 3 × 10 14)، والذي سيزن فقط 0.0000001 جرام.
الجزيئات
من النادر العثور على مجموعات من الذرات الفردية. فقط عدد قليل من العناصر، مثل غاز الهيليوم Gases Helium والنيون Neon والأرجون Argon، تتكون من مجموعة من الذرات الفردية التي تتحرك بشكل مستقل عن بعضها البعض. تتكون العناصر الأخرى، مثل غازات الهيدروجين والنيتروجين والأكسجين والكلور، من وحدات تتكون من أزواج من الذرات (الشكل 1.11).
يتكون أحد أشكال عنصر الفسفور من وحدات تتكون من أربع ذرات فوسفور. يتواجد عنصر الكبريت في أشكال مختلفة، يتكون أحدها من وحدات تتكون من ثماني ذرات من الكبريت. وتسمى هذه الوحدات الجزيئات. يتكون الجزيء Molecule من ذرتين أو أكثر يتم انضمامهما بواسطة قوى قوية تسمى الروابط الكيميائية. تتحرك الذرات الموجودة في الجزيء كوحدة واحدة، مثل علب الصودا في حزمة من ستة علب أو حفنة من المفاتيح التي تنضم معًا في حلقة لتشكل سلسلة مفاتيح واحدة.
قد يتكون الجزيء من ذرتين أو أكثر، كما هو الحال في الجزيئات الموجودة في عناصر الهيدروجين، الأكسجين، والكبريت، أو قد يتكون من أكثر من ذرتين، كما في الجزيئات الموجودة في الماء. كل جزيء ماء هو وحدة تحتوي على ذرتين للهيدروجين وذرة أكسجين واحدة. كل جزيء من الجلوكوز هو وحدة تحتوي على 6 ذرات كربون، و12 ذرة هيدروجين، و6 ذرات أكسجين. مثل الذرات، فإن الجزيئات صغيرة بشكل لا يصدق وخفيفة أيضًا. إذا تم توسيع حجم كوب عادي من الماء إلى حجم الأرض، فإن جزيئات الماء بداخل الكوب ستكون بحجم كرات الجولف.
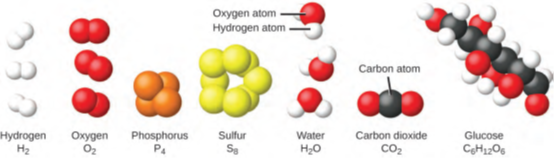
الشكل 1.11: جزيئات عناصر الهيدروجين، والأكسجين، والفوسفور، والكبريت تتكون من ذرتين أو أكثر من نفس العنصر. تتكون مركبات الماء وثاني أكسيد الكربون والجلوكوز من مجموعات من ذرات العناصر المختلفة.
تصنيفات المادة
يمكننا تصنيف المادة إلى عدة فئات. فئتان أساسيتان هما الخليط والمواد النقية. المادة النقية Pure Substance لها تكوين ثابت. جميع عينات المادة النقية لها نفس التكوين والخصائص. تتكون أي عينة من السكروز (سكر المائدة) من 42.1 ٪ من الكربون، و6.5 ٪ من الهيدروجين، و51.4 ٪ من الأكسجين حسب الكتلة. أي عينة من السكروز لها أيضًا نفس الخصائص الفيزيائية، مثل نقطة الانصهار واللون والحلاوة، بغض النظر عن المصدر الذي يتم عزلها منه.
يمكننا تقسيم المواد النقية إلى فئتين: عناصر Elements ومركّبات Compounds. وتسمى المواد النقية التي لا يمكن تقسيمها إلى مواد أبسط عن طريق التغييرات الكيميائية عناصر. الحديد والفضة والذهب والألمنيوم والكبريت والأكسجين والنحاس هي أمثلة مألوفة لأكثر من 100 عنصر معروف، منها حوالي 90 تتواجد بشكل طبيعي على الأرض، وتم إنشاء عشرين أو نحو ذلك في المختبرات.
العناصر والمركّبات الكيميائية
وتسمى المواد النقية التي يمكن تقسيمها عن طريق التغييرات الكيميائية باسم المركّبات. قد ينتج هذا التقسيم إما عناصر أو مركبات أخرى، أو كليهما. مركب أكسيد الزئبق، ذو اللون البرتقالي، والحالة الصلبة البلورية، يمكن تقسيمه بالحرارة إلى عناصر الزئبق والأكسجين (الشكل 1.12). عند تسخينه في غياب الهواء، يتم تقسيم مركب السكروز إلى عنصر الكربون ومركّب الماء. (تُعرف المرحلة الأولية من هذه العملية، عندما يصبح السكر بنيًا، باسم الكراميل Caramelization، (وهذا ما يضفي نكهة الحلو المميزة لتفاح الكراميل والبصل بالكراميل والكراميل). كلوريد الفضة هو مادة صلبة بيضاء يمكن تحللها إلى عناصرها، الفضة والكلور، عن طريق امتصاص الضوء. هذه الخاصية هي الأساس لاستخدام هذا المركب في الأفلام الفوتوغرافية والنظارات الضوئية (تلك ذات العدسات التي تغمق عند تعرضها للضوء).

الشكل 1.12: (أ) مركب أكسيد الزئبق، (ب) عند تسخينه، (ج) يتحلل إلى قطرات فضية من الزئبق السائل وغاز الأكسجين غير المرئي. (المصدر: Paul Flowers)
رابط فيديو تعليمي
العديد من المركبات تتحلل عند تسخينها. يوضح هذا الفيديو تحلل أكسيد الزئبق، HGO. يمكنك أيضًا عرض مثال على التحلل الكيميائي الضوئي لكلوريد الفضة، AgCl.
تختلف خصائص العناصر المركبة عن تلك الموجودة في الحالة الحرة أو غير المركبة. على سبيل المثال، السكر البلوري الأبيض (السكروز) هو مركب ناتج عن المزيج الكيميائي لعنصر الكربون، وهو مادة صلبة بلون أسود في أحد أشكاله غير المركبة، والعنصرين الهيدروجين والأكسجين، وهما غازات عديمة اللون عندما تكون غير مركبة.
والصوديوم الحر، وهو عبارة عن عنصر ناعم ومعدني لامع. والكلورين الحر وهو عنصر غازي أخضر مصفر، يجتمعان ليكوّنا مركب كلوريد الصوديوم (ملح المائدة)، وهو مركب أبيض اللون بلوري صلب.
الخليط والمحلول
يتكون الخليط Mixture من نوعين أو أكثر من المواد التي يمكن أن تكون موجودة بكميات مختلفة ويمكن فصلها عن طريق تغييرات مادية، مثل التبخر (سوف تتعلم المزيد حول هذا لاحقًا). يسمى الخليط الذي له تكوين يختلف من نقطة إلى نقطة مزيج غير متجانس Heterogeneous Mixture. الصلصة الإيطالية هي مثال على خليط غير متجانس (الشكل 1.13). يمكن أن يختلف تكوينها لأننا نستطيع أن نجعلها من كميات متفاوتة من الزيت والخل والأعشاب، والذي لا يكون هو نفسه من نقطة إلى أخرى في جميع أنحاء الخليط – فقد تتكون إحدى القطرات في الغالب من الخل، في حين أن قطرة أخرى قد تتكون في الغالب من الزيت أو الأعشاب، لأن الزيت والخل ينفصلان وتبقى الأعشاب). ومن الأمثلة الأخرى على الخليط غير المتجانس كعكات الشوكولاتة (يمكننا أن نرى أجزاء منفصلة من الشوكولاتة والمكسرات وعجين الكعك)، وكذلك الجرانيت (يمكننا رؤية الكوارتز والميكا والفلسبار والمزيد).
الخليط المتجانس Homogeneous Mixture يسمى أيضًا محلول Solution، وهو عبارة عن تركيبة نموذجية ويظهر بصريًا على نفس الشكل. مثال على المحلول هو مشروب رياضي يتكون من الماء والسكر والصبغة والنكهة المخلوطة معًا بشكل نموذجي (الشكل 1.13). يتم تذوق كل قطرة من المشروبات الرياضية بنفس الطعم لأن كل قطرة تحتوي على نفس كميات الماء والسكر والمكونات الأخرى. لاحظ أن تكوين المشروب الرياضي يمكن أن يختلف، فيمكن أن يكون مصنوعًا إلى حد ما من السكر أو النكهة أو المكونات الأخرى، ولكنه لا يزال مشروبًا رياضيًا. ومن الأمثلة الأخرى على الخليط المتجانس الهواء والبنزين ومحلول الملح في الماء.

الشكل 1.13: (أ) صلصة الزيت والخل الإيطالية هي خليط غير متجانس لأن تكوينها ليس موحدًا طوال الوقت. (ب) مشروب رياضي تجاري هو خليط متجانس لأن تكوينه موحد طوال الوقت. (المصدر: يسار John Mayer، يمين Umberto Salvagnin).
خريطة تصنيفات المادة
على الرغم من وجود ما يزيد قليلاً عن 100 عنصر، فإن عشرات الملايين من المركبات الكيميائية تنجم عن مجموعات مختلفة من هذه العناصر. يحتوي كل مركب على تركيبة محددة ويمتلك خصائص كيميائية وفيزيائية محددة يمكننا من خلالها التمييز بينها عن جميع المركبات الأخرى. وبالطبع، هناك طرق لا حصر لها لتركيب العناصر والمركبات لتشكيل مخاليط مختلفة. يظهر ملخص لكيفية التمييز بين التصنيفات الرئيسية المختلفة للمادة (الشكل 1.14).
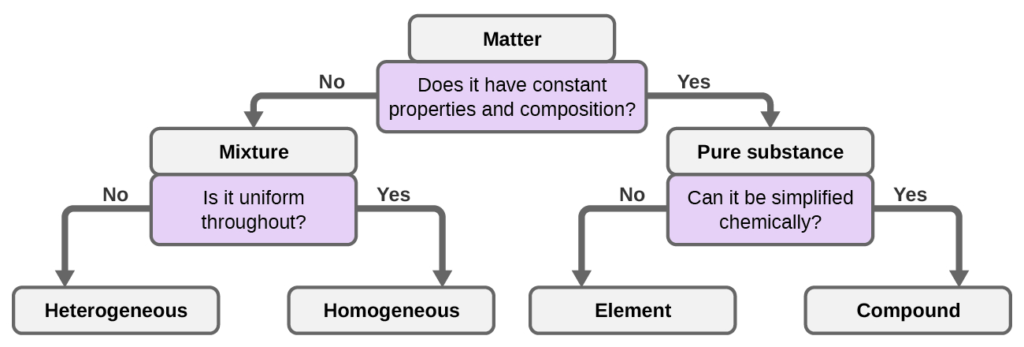
الشكل 1.14: اعتمادًا على خصائصها، يمكن تصنيف مادة معينة على أنها خليط متجانس أو خليط غير متجانس أو مركب أو عنصر.
يشكل أحد عشر عنصرًا حوالي 99٪ من قشرة الأرض والجو (الجدول 1.1). يشكل الأكسجين ما يقرب من النصف والسيليكون حوالي ربع الكمية الكلية لهذه العناصر. تم العثور على غالبية العناصر على الأرض في مركبات كيميائية مع عناصر أخرى؛ تم العثور على حوالي ربع العناصر في الحالة الحرة.
| العنصر | الرمز | النسبة المؤية |
| أكسجين | O | 49.20 |
| سيليكون | Si | 25.67 |
| ألمنيوم | Al | 7.50 |
| حديد | Fe | 3.39 |
| كالسيوم | Ca | 2.63 |
| بوتاسيوم | K | 2.40 |
| ماغنسيوم | Mg | 1.93 |
| هيدروجين | H | 0.87 |
| تيتانيوم | Ti | 0.58 |
الكيمياء في الحياة اليومية
تحلل الماء / إنتاج الهيدروجين
يتكون الماء من عناصر الهيدروجين والأكسجين مجتمعين في نسبة 2 إلى 1. يمكن تحليل الماء إلى غازات الهيدروجين والأكسجين بإضافة الطاقة. طريقة واحدة للقيام بذلك هي مع بطارية أو مصدر طاقة، كما هو موضح في (الشكل 1.15).
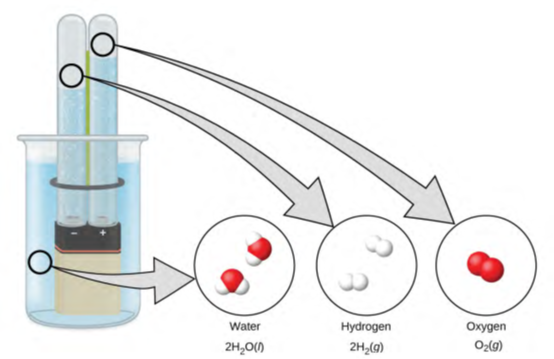
توفر البطارية تيارًا كهربائيًا (مجهري) يحلل الماء. على المستوى العين المجردة، ينفصل السائل إلى غازات الهيدروجين (على اليسار) والأكسجين (على اليمين). من الناحية الرمزية، يتم تقديم هذا التغيير من خلال إظهار كيف يتحلل السائل H2O إلى غازات H2 و O2.
يتضمن تحلل الماء إعادة ترتيب الذرات في جزيئات الماء إلى جزيئات مختلفة، يتكون كل منها من ذرتين هيدروجين وذرتين من الأكسجين، على التوالي. يشكل جزيئان الماء جزيء أكسجين واحد وجزيئين للهيدروجين. سيتم استكشاف تمثيل ما يحدث بتعمق أكبر في الفصول اللاحقة، حاليًا يمكن التعبير عن ذلك بالرموز على الشكل التالي:
2 H2O (Liquid) ⟶ 2 H2 (Gaz) + O2 (Gaz)
مركبات خلايا الوقود
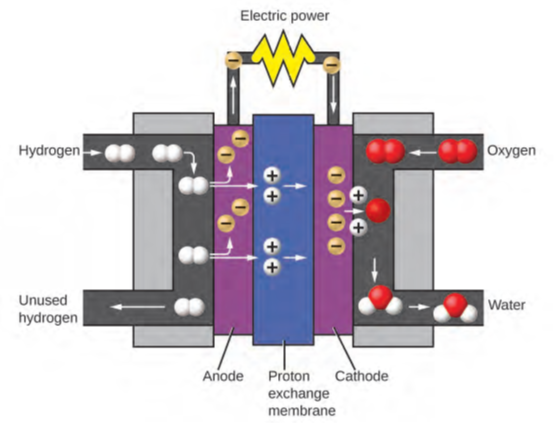
الغازات المنتجة لهما خصائص مختلفة بشكل واضح. الأكسجين غير قابل للاشتعال ولكنه مطلوب لاحتراق الوقود، والهيدروجين قابل للاشتعال ومصدر طاقة قوي. كيف يمكن تطبيق هذه المعرفة في عالمنا؟ ينطوي أحد التطبيقات على البحث عن وسائل نقل أكثر كفاءة في استهلاك الوقود. تعمل مَركبات خلايا الوقود Fuel-Cell Vehicles (FCV) على الهيدروجين بدلاً من البنزين (الشكل 1.16). إنها أكثر كفاءة من المَركبات ذات محركات الاحتراق الداخلية، وهي غير ملوثة للبيئة، وتقلل من انبعاثات غازات الدفيئة، مما يجعلنا أقل اعتمادًا على الوقود الأحفوري. FCVs ليست قابلة للحياة اقتصاديًا بعد، ويعتمد إنتاج الهيدروجين الحالي على الغاز الطبيعي. إذا تمكنا من تطوير عملية لتحلل المياه اقتصاديًا، أو إنتاج الهيدروجين بطريقة أخرى سليمة بيئيًا، فقد تكون مَركبات خلايا الوقود FCVs هي طريق المستقبل.
كيمياء الهواتف المحمولة
تخيل كيف ستختلف حياتك لو كانت بدون هواتف محمولة (الشكل 1.17) والأجهزة الذكية الأخرى. تصنع الهواتف المحمولة من العديد من المواد الكيميائية، والتي يتم استخلاصها، وتكريرها، وتنقيتها، وتجميعها باستخدام فهم واسع النطاق ومتعمق للمبادئ الكيميائية. تم العثور على حوالي 30٪ من العناصر الموجودة في الطبيعة داخل هاتف ذكي نموذجي. تتكون العلبة/الجسم/الإطار من مزيج من البوليمرات القوية والمتينة التي تتكون في المقام الأول من الكربون والهيدروجين والأكسجين والنيتروجين [السترين (ABS) والمعادن البنية البولينية، والمعادن الهيكلية القوية، مثل الألومنيوم، المغنيسيوم والحديد). شاشة العرض مصنوعة من زجاج مشدود بشكل خاص (زجاج السيليكا معزز بإضافة الألومنيوم والصوديوم والبوتاسيوم) ومغلفة بمواد لجعلها موصلة (مثل أكسيد القصدير والإنديوم). تستخدم لوحة الدائرة الكهربائية مادة أشباه الموصلات (عادة السيليكون)؛ المعادن شائعة الاستخدام مثل النحاس والقصدير والفضة والذهب؛ والمزيد من العناصر غير المألوفة مثل Yttrium وPraseodymium وGadolinium. تعتمد البطارية على أيونات الليثيوم ومجموعة متنوعة من المواد الأخرى، بما في ذلك الحديد والكوبالت والنحاس وأكسيد البولي إيثيلين والبولي أكريلونيتريل.
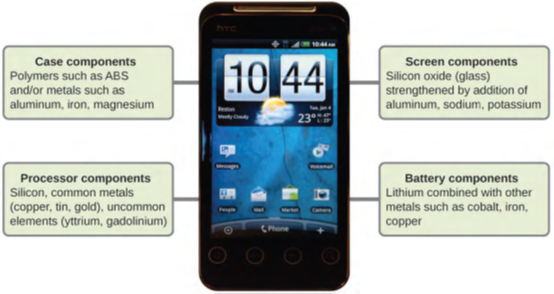
الشكل 1.17: ما يقرب من ثلث العناصر التي توجد بشكل طبيعي تستخدم في صنع هاتف خلوي. (المصدر: بواسطة جون تايلور).
المراجع
- مقرر الكيمياء، كلية OpenStax، سنة OpenStax College, Chemistry ،2015.
- موسوعة الكيمياء من الألف إلى الياء، ترجمة وإعداد: د. م. مصطفى عبيد، مركز البحوث والدراسات متعدد التخصصات، إسطنبول، 2022-2023