ملخص المحتوى
الخصائص الكيميائية والفيزيائية، مفهومها والتمييز بينها، التغيرات الكيميائية أو الفيزيائية التي تحدث للمادة، تصنيف الخصائص إلى واسعة النطاق أو مكثّفة والفرق بينهما. رمز الخطر للمواد الكيميائية، الجدول الدوري.
المحتويات
الخصائص الكيميائية والفيزيائية
بنهاية هذا القسم، ستكون قادرًا على:
- تحديد الخصائص والتغيرات الكيميائية أو الفيزيائية في المادة
- تحديد الخصائص الكيميائية للمادة واسعة النطاق أو المكثّفة
الخصائص الفيزيائية
تسمى الخصائص التي تمكّننا من تمييز مادة عن أخرى بالخصائص. الخاصية الفيزيائية هي خاصية للمادة التي لا ترتبط بتغيير في تركيبها الكيميائي. تشمل الأمثلة المألوفة للخصائص الفيزيائية الكثافة، واللون، والصلابة، ونقاط الانصهار والغليان، والتوصيل الكهربائي. ويمكننا ملاحظة بعض الخصائص الفيزيائية، مثل الكثافة واللون، دون تغيير الحالة الفيزيائية للمادة الملحوظة. يمكن ملاحظة الخصائص الفيزيائية الأخرى، مثل درجة حرارة انصهار الحديد أو درجة حرارة تجمد الماء، فقط عندما تخضع المادة لتغير فيزيائي.
التغيير الفيزيائي هو تغيير في حالة أو خصائص المادة دون أي تغيير مصاحب في تركيبها الكيميائي (طبيعة المواد الموجودة في المادة). نلاحظ تغيرًا فيزيائيًا عندما يذوب الشمع، وعندما يذوب السكر في القهوة، وعندما يتكثف البخار ويكوّن الماء السائل (الشكل 1.18). تشمل الأمثلة الأخرى للتغيرات الفيزيائية المغناطيسية وإزالة المغناطيسية للمعادن (كما هو الحال مع المنبهات الأمنية الشائعة لمكافحة السرقة) وطحن المواد الصلبة إلى مساحيق (والتي يمكن أن تسفر في بعض الأحيان عن تغيرات ملحوظة في اللون). في كل من هذه الأمثلة، هناك تغيير في الحالة الفيزيائية للمادة أو شكلها أو خصائصها، ولكن لا يوجد تغيير في تركيبها الكيميائي.

الشكل 1.18: (أ) يخضع الشمع لتغيير مادي عندما يتم تسخين الشمع الصلب ويشكل شمعًا سائلًا. (ب) يعتبر تكثيف البخار داخل وعاء الطهي تغيرًا فيزيائيًا، حيث يتحول بخار الماء إلى ماء سائل. (المصدر: أ. ويكيميديا كومنز؛ ب. Mjneuby, Flickr).
الخصائص الكيميائية
يعتبر تغيير نوع من المادة إلى نوع آخر (أو عدم القدرة على التغيير) خاصية كيميائية. تتضمن أمثلة الخصائص الكيميائية القابلية للاشتعال والسُميّة والحموضة والتفاعلية (أنواع عديدة) وحرارة الاحتراق. الحديد، على سبيل المثال، يتحد مع الأكسجين في وجود الماء لتكوين الصدأ؛ لا يتأكسد الكروم (الشكل 1.19). النتروجليسرين شديد الخطورة لأنه ينفجر بسهولة. لا يشكل النيون أي خطر تقريبًا لأنه غير نشط للغاية.

الشكل 1.19: (أ) من الخصائص الكيميائية للحديد أنه يصدأ؛ (ب) تتمثل إحدى الخصائص الكيميائية للكروم في أنه لا يصدأ. (المصدر: أ. بواسطة توني هيسجيت؛ ب. بواسطة أتوما، ويكيميديا كومنز).
التمييز بي الخصائص الكيميائية والفيزيائية
لتحديد خاصية كيميائية، نبحث عن تغيير كيميائي. ينتج عن التغيير الكيميائي دائمًا نوعًا واحدًا أو أكثر من المواد التي تختلف عن المادة الموجودة قبل التغيير. يُشكل الصدأ تغيرًا كيميائيًا لأن الصدأ مادة مختلفة عن الحديد والأكسجين والماء الموجودين قبل تكوين الصدأ. إن انفجار النيتروجليسرين هو تغيير كيميائي لأن الغازات المُنتجة هي أنواع مختلفة جدًا من المادة عن المادة الأصلية. تشمل الأمثلة الأخرى للتغيرات الكيميائية التفاعلات التي يتم إجراؤها في المختبر (مثل تفاعل النحاس مع حمض النيتريك)، وجميع أشكال الاحتراق (الاشتعال)، والطعام الذي يتم طهيه أو هضمه أو تعفنه (الشكل 1.20).

الشكل 1.20: (a) يخضع النحاس وحمض النيتريك لتغيير كيميائي لتشكيل نترات النحاس وثاني أكسيد النيتروجين الغازي البني. (b) أثناء احتراق عود الكبريت، يخضع السليلوز الموجود في عود الثقاب والأكسجين من الهواء لتغير كيميائي لتكوين ثاني أكسيد الكربون وبخار الماء. (c) يتسبب طهي اللحوم الحمراء في حدوث عدد من التغيرات الكيميائية، بما في ذلك أكسدة الحديد في الهيموجلوبين الذي ينتج عنه تغير اللون المألوف من الأحمر إلى البني. (d) تحوّل لون الموز إلى اللون البني هو تغيير كيميائي حيث تتشكل مواد جديدة أغمق (وأقل طعمًا). (المصدر ب. بواسطة جيف تيرنر؛ ج. بواسطة غلوريا كابادا-ليمان؛ د. روبرتو فيرزو).
الخصائص واسعة النطاق والخصائص المكثّفة
تنقسم خصائص المادة إلى فئتين. إذا كانت الخاصية تعتمد على مقدار المادة الموجودة، فهي خاصية واسعة النطاق Extensive Property. تعتبر كتلة وحجم المادة أمثلة على خصائص واسعة النطاق؛ على سبيل المثال، يحتوي جالون من الحليب على كتلة وحجم أكبر من كوب الحليب. قيمة الخاصية واسعة النطاق تتناسب طرديًا مع مقدار المادة المعنية.
إذا كانت خاصية عينة من المادة لا تعتمد على كمية المادة الموجودة، فهي خاصية مكثّفة Intensive Property. درجة الحرارة هي مثال على خاصية مكثفة. إذا كانت درجة حرارة كل من جالون وكوب الحليب 20 درجة مئوية (درجة حرارة الغرفة)، عند مزجهما، تظل درجة الحرارة عند 20 درجة مئوية. كمثال آخر، ضع في اعتبارك بعض الخصائص المميزة ولكنها خصائص مرتبطة مع بعضها، مثل الحرارة ودرجة الحرارة. يسبب تناثر قطرة من زيت الطهي الساخن على ذراعك إزعاجًا طفيفًا وجيزًا، بينما يتسبب إناء الزيت الساخن في حروق شديدة. كل من قطرة ووعاء الزيت لهما نفس درجة الحرارة (خاصية مكثفة)، لكن من الواضح أن الإناء يحتوي على قدر أكبر من الحرارة (خاصية واسعة النطاق).
رمز الخطر للمواد الكيميائية
ربما تكون قد رأيت الرمز الموضح في الشكل 1.21 على حاويات المواد الكيميائية في المختبر أو مكان العمل. يُطلق عليه أحيانًا “المعين الناري” أو “معين الخطر” Hazard Diamond. ويوفر رمز الخطر الكيميائي هذا معلومات قيّمة تلخّص بإيجاز المخاطر المختلفة التي يجب أن تكون على دراية بها عند التعامل مع مادة معيّنة.
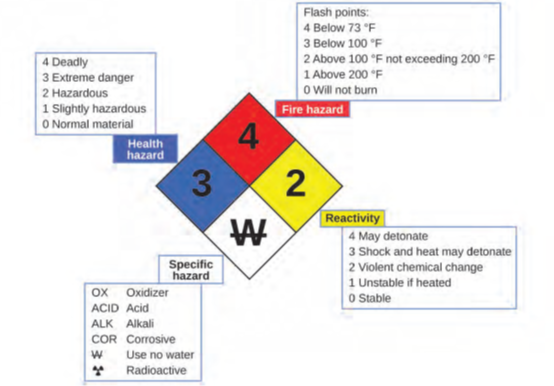
تم تطوير نظام تحديد المخاطر للوكالة الوطنية للحماية من الحرائق (NFPA) 704 بواسطة NFPA لتوفير معلومات السلامة حول بعض المواد. يفصّل النظام القابلية للاشتعال والتفاعلية والصحة والمخاطر الأخرى. ضمن رمز الخطر الكلي، يحدد الماسة العلوية (الأحمر) مستوى خطر الحريق (نطاق درجة الحرارة لنقطة الوميض). يشير الماسة الزرقاء (الأيسر) إلى مستوى المخاطر الصحية. تصف الماسة الصفراء (الأيمن) مخاطر التفاعل، مثل مدى سهولة تعرض المادة للانفجار أو تغيير كيميائي عنيف. تشير الماسة البيضاء (السفلي) إلى مخاطر خاصة، مثل ما إذا كان مؤكسدًا (مما يسمح للمادة بالاحتراق في غياب الهواء / الأكسجين)، أو تخضع لتفاعل غير عادي أو خطير مع الماء، أو تآكل المادة، الحمضية، القلوية، خطر بيولوجي، خطر الإشعاع، وما إلى ذلك. يتم تصنيف كل خطر على مقياس من 0 إلى 4، حيث صفر تعني عدم وجود أي خطر و4 تمثل خطورة بالغة.
في حين أن العديد من العناصر تختلف بشكل كبير في خواصها الكيميائية والفيزيائية، فإن بعض العناصر لها خصائص متشابهة. يمكننا تحديد مجموعات العناصر التي تظهر سلوكيات مشتركة. على سبيل المثال، العديد من العناصر توصّل الحرارة والكهرباء بشكل جيد، في حين أن البعض الآخر يكون من الموصلات الضعيفة. يمكن استخدام هذه الخصائص لفرز العناصر إلى ثلاث فئات: المعادن (العناصر التي توصل بشكل جيد)، واللافلزات (العناصر التي توصل بشكل سيئ)، والفلزات (العناصر التي لها خصائص كل من المعادن واللافلزات).
الجدول الدوري
الجدول الدوري هو جدول عناصر يضع العناصر ذات الخصائص المتشابهة قريبة من بعضها البعض (الشكل 1.22).
سوف تتعلم المزيد عن الجدول الدوري مع استمرار دراستك للكيمياء.
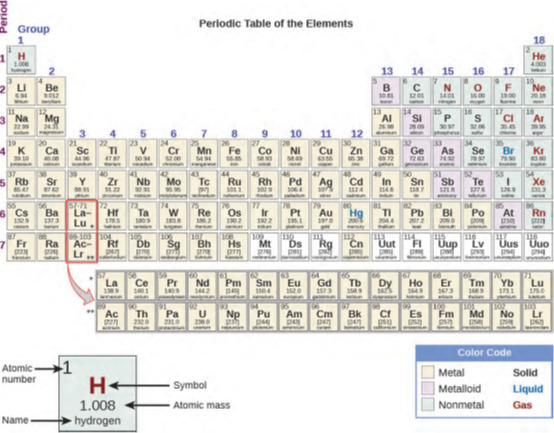
الشكل 1.22: يوضح الجدول الدوري كيف يمكن تجميع العناصر وفقًا لبعض الخصائص الكيميائية والفيزيائية المتشابهة. لاحظ أن لون الخلفية يشير إلى ما إذا كان العنصر معدنًا أو فلزًا معدنيًا أو غير معدني، بينما يشير لون رمز العنصر إلى ما إذا كان صلبًا أم سائلًا أم غازًا.
المراجع
- مقرر الكيمياء، كلية OpenStax، تاريخ النشر OpenStax College, Chemistry ،11 March 2015. الفصل الأول، الأفكار والمفاهيم الاساسية في الكيمياء.
- موسوعة الكيمياء من الألف إلى الياء، ترجمة وإعداد: د. م. مصطفى عبيد، مركز البحوث والدراسات متعدد التخصصات، إسطنبول، 2022-2023.