الذرات والجزيئات والأيونات
هذا الفصل مخصص لدراسة موضوع الذرات والجزيئات والأيونات. ويبدأ بدراسة النظرية الذرية وتطورها، الصيغ الكيميائية، الجدول الدوري، المركّبات الجزيئية والأيونية، والتسمية الكيميائية. وقد تقسيم كل من هذه الموضوعات بشكل مستقل. ويبدأ هذا الفصل بمدخل لدراسة الذرات والأفكار المبكرة في النظرية الذرية، نظرية دالتون الذرية وتطورها، قانون النسب المحددة وقانون النسب المتعددة مع التوضيح بالأمثلة.
مخطط الفصل الثاني:
- 2.1 الذرات ونظرية دالتون الذرية
- 2.2 النظرية الذرية الحديثة
- 2.3 التركيب الذري والرموز الذرية
- 2.4 الصيغ الكيميائية
- 2.5 الجدول الدوري
- 2.6 المركّبات الجزيئية والأيونية
- 2.7 التسمية الكيميائية
- رابط تصفح الفصل الأول من الكتاب: الأفكار والمفاهيم الأساسية في الكيمياء
المحتويات
مدخل لدراسة الذرات
تعتمد صحتك العامة وقابليتك للإصابة بالمرض على التفاعل المعقّد بين التركيب الجيني والتعرض البيئي، مع صعوبة التنبؤ بالنتيجة. يمكن أن يسمح الاكتشاف المبكر للمؤشرات الحيوية، والمواد التي تشير إلى مرض الكائن الحي أو الحالة الفسيولوجية، بالتشخيص والعلاج قبل أن تصبح الحالة خطيرة أو لا رجعة فيها. أظهرت الدراسات الحديثة أن نَفَس الزفير يمكن أن يحتوي على جزيئات قد تكون مؤشرات حيوية للتعرض مؤخرًا للملوثات البيئية أو للحالات المرضية التي تتراوح من الربو إلى سرطان الرئة. يعمل العلماء على تطوير “بصمات أصابع Fingerprints”” العلامات الحيوية التي يمكن استخدامها لتشخيص مرض معين بناءً على كميات وهويات جزيئات معيّنة في زفير المريض. أحد المفاهيم الأساسية الكامنة وراء هذا الهدف هو هوية الجزيء، والتي يتم تحديدها من خلال أعداد وأنواع الذرات التي يحتوي عليها، وكيفية ارتباطها ببعضها البعض. سيصف هذا الفصل بعض المبادئ الكيميائية الأساسية المتعلقة بتكوين المادة، بما في ذلك المبادئ الأساسية لمفهوم الهوية الجزيئية Molecular Identity.
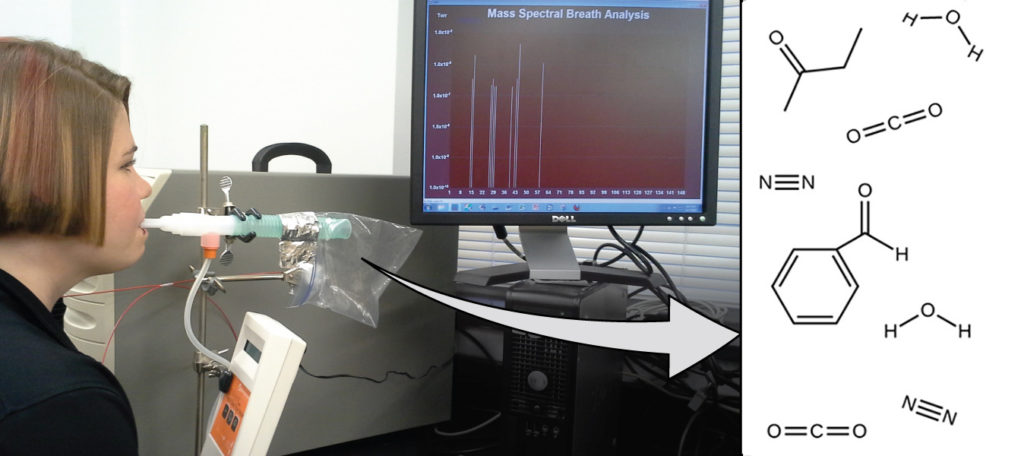
الشكل 2.1: يمكن أن يوفر تحليل الجزيئات في نَفَس الزفير معلومات قيمة، مما يؤدي إلى التشخيص المبكر للأمراض أو الكشف عن التعرض البيئي للمواد الضارة. (المصدر: باول فلاورز Paul Flowers).
الأفكار المبكرة في النظرية الذرية
بنهاية هذا القسم، ستكون قادرًا على:
- ذكر افتراضات نظرية دالتون الذرية
- استخدم افتراضات نظرية دالتون الذرية لشرح قوانين النسب المحددة والمتعددة
إن اللغة المستخدمة في الكيمياء تُرى وتُسمع في العديد من التخصصات، بدءًا من الطب إلى الهندسة إلى الطب الشرعي إلى الفنون. تتضمن لغة الكيمياء مفرداتها الخاصة بالإضافة إلى شكلها الخاص في الاختصار.
تُستخدم الرموز الكيميائية لتمثيل الذرات والعناصر. تصور الصيغ الكيميائية الجزيئات وكذلك تكوين المركّبات. توفّر المعادلات الكيميائية معلومات حول جودة وكمية التغييرات المرتبطة بالتفاعلات الكيميائية.
سيضع هذا الفصل الأساس لدراستنا للغة الكيمياء. تتضمن مفاهيم هذا الأساس النظرية الذرية، وتكوين الذرة وكتلتها، وتنوع تكوين النظائر، وتكوين الأيونات، والروابط الكيميائية الأيونية والتساهمية في المركّبات، وأنواع التفاعلات الكيميائية، وتسمية المركبات. سنقدم أيضًا واحدة من أقوى الأدوات لتنظيم المعرفة الكيميائية وهو الجدول الدوري.
النظرية الذرية خلال القرن التاسع عشر
أقرب مناقشة مسجلة للبنية الأساسية للمادة تأتي من الفلاسفة اليونانيين القدماء، العلماء في عصرهم. في القرن الخامس قبل الميلاد، جادل Leucippus وDemocritus بأن كل المادة تتكون من جسيمات صغيرة محدودة أطلقوا عليها اسم atomos، وهو مصطلح مشتق من الكلمة اليونانية التي تعني “غير قابل للتجزئة”. لقد اعتقدوا أن الذرات جسيمات متحركة تختلف في الشكل والحجم ويمكن أن تتحد معًا. في وقت لاحق، توصّل أرسطو وآخرون إلى استنتاج مفاده أن المادة تتكون من مجموعات مختلفة من “العناصر” elements الأربعة، النار والأرض والهواء والماء، ويمكن تقسيمها إلى ما لا نهاية. ومن المثير للاهتمام أن هؤلاء الفلاسفة فكروا في الذرات و “العناصر” كمفاهيم فلسفية، لكن من الواضح أنهم لم يفكروا أبدًا في إجراء تجارب لاختبار أفكارهم.
سادت النظرة الأرسطية لتكوين المادة لأكثر من ألفي عام، حتى ساعد مدرس اللغة الإنجليزية جون دالتون في إحداث ثورة في الكيمياء بفرضيته القائلة بأن سلوك المادة يمكن تفسيره باستخدام النظرية الذرية. نُشر لأول مرة في عام 1807، العديد من فرضيات دالتون حول السمات المجهرية للمادة لا تزال صالحة في النظرية الذرية الحديثة. فيما يلي افتراضات نظرية دالتون الذرية.
افتراضات نظرية دالتون الذرية حول الذرات
1. تتكون المادة من جسيمات صغيرة جدًا تسمى الذرات. الذرة هي أصغر وحدة في العنصر يمكن أن تشارك في تغيير كيميائي.
2. يتكون العنصر من نوع واحد فقط من الذرات، والذي له كتلة مميّزة للعنصر وهي واحدة لجميع ذرات هذا العنصر (الشكل 2.2). تحتوي العينة العيانية لعنصر ما على عدد كبير بشكل لا يصدق من الذرات، وكلها لها خصائص كيميائية متطابقة.

الشكل 2.2: قطعة نقدية نحاسية تعود إلى ما قبل عام 1982 (يسار) تحتوي على ما يقرب من 3 × 10 22 ذرة نحاسية (يتم تمثيل عدة عشرات على شكل كرات بنية على اليمين)، ولكل منها نفس الخصائص الكيميائية. (المصدر: بواسطة slgckgc / Flickr).
3. تختلف ذرات عنصر واحد في خصائصها عن ذرات جميع العناصر الأخرى.
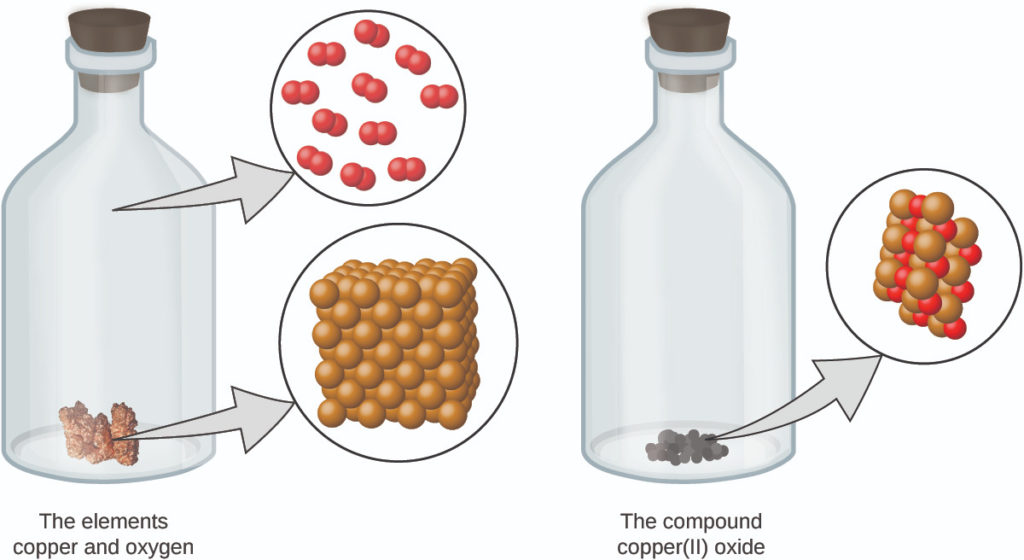
4. يتكون المركّب من ذرات مكوّنة من عنصرين أو أكثر مركّبة في نسبة صغيرة من عدد صحيح. في مركّب معين، تكون أعداد الذرات لكل عنصر من عناصره موجودة دائمًا بنفس النسبة (الشكل 2.3).

الشكل 2.3: ثاني أكسيد النحاس، مركب مسحوق أسود، ينتج عن مزيج من نوعين من الذرات – النحاس (الكرات البنية) والأكسجين (الكرات الحمراء) – بنسبة 1: 1. (المصدر: بواسطة Chemicalinterest / ويكيميديا كومنز).
5. لا يتم إنشاء الذرات أو تدميرها أثناء تغيير كيميائي، ولكن يتم إعادة ترتيبها بدلاً من ذلك لإنتاج مواد مختلفة عن تلك الموجودة قبل التغيير (الشكل 2.4).
نظرية دالتون وقانون حفظ المادة
الشكل 2.4: عندما تتفاعل العناصر النحاس (مادة صلبة بنية حمراء لامعة، كما هو موضح هنا على شكل كرات بنية) والأكسجين (غاز شفاف وعديم اللون، كما هو موضح هنا في صورة كريات حمراء)، فإن ذراتها تعاد ترتيبها لتشكل مركبًا يحتوي على النحاس والأكسجين (مسحوق أسود صلب). (المصدر: https://imagesof-elements.com/copper.php).
تقدم نظرية دالتون الذرية تفسيرًا مجهريًا للعديد من الخصائص العيانية للمادة التي تعرفت عليها. على سبيل المثال، إذا كان عنصر مثل النحاس يتكون من نوع واحد فقط من الذرات، فلا يمكن تقسيمه إلى مواد أبسط، أي إلى مواد تتكون من أنواع أقل من الذرات. وإذا لم يتم إنشاء الذرات أو تدميرها أثناء تغيير كيميائي، فإن الكتلة الكلية للمادة الموجودة عندما تتغير المادة من نوع إلى آخر ستبقى ثابتة (قانون حفظ المادة).
مثال 2.1: اختبار نظرية دالتون الذرية
في الرسم التالي، تمثل الكرات الخضراء ذرات عنصر معين. تمثل الكرات الأرجوانية ذرات عنصر آخر. إذا تلامست الكرات، فهي جزء من وحدة مفردة من المركّب. هل التغيير الكيميائي التالي الذي تمثله هذه الرموز ينتهك أيًا من أفكار نظرية دالتون الذرية؟ إذا كان كذلك؛ فأي منها؟
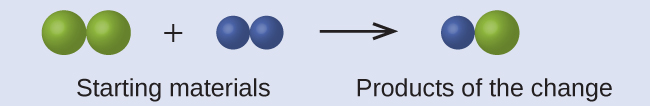
الحل:
تتكون مواد البداية من كرتين من الكرات الخضراء واثنتين من الكرات الأرجوانية. تتكون النواتج من كرة خضراء واحدة فقط وكرة أرجوانية واحدة فقط. هذا ينتهك افتراض دالتون القائل بأن الذرات لا يتم إنشاؤها أو تدميرها أثناء تغيير كيميائي، ولكن يتم إعادة توزيعها فقط. (في هذه الحالة، يبدو أن الذرات قد دمرت).
تحقق من فهمك:
في الرسم التالي، تمثل الكرات الخضراء ذرات عنصر معين. تمثل الكرات الأرجوانية ذرات عنصر آخر. إذا تلامست الكرات، فهي جزء من وحدة مفردة من المركب. هل التغيير الكيميائي التالي الذي تمثله هذه الرموز ينتهك أيًا من أفكار نظرية دالتون الذرية؟ إذا كان كذلك؛ فأي منها؟
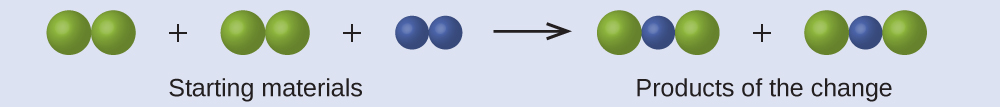
الإجابة: تتكون مواد البداية من أربع كرات خضراء وكراتين أرجوانية. تتكون النواتج من أربع كرات خضراء واثنين من الكرات الأرجوانية. هذا لا ينتهك أيًا من افتراضات دالتون: لا يتم إنشاء الذرات أو تدميرها، ولكن يتم إعادة توزيعها بنسب صغيرة من الأعداد الصحيحة.
تطور نظرية دالتون الذرية
قانون النسب المحددة في الذرات
علم دالتون بتجارب الكيميائي الفرنسي جوزيف بروست، الذي أظهر أن “جميع عينات المركّب النقي تحتوي على نفس العناصر بنفس النسبة في الكتلة. يُعرف هذا البيان باسم قانون النسب المحددة Law of Definite Proportions أو قانون التكوين الثابت Law of Constant Composition. الاقتراح القائل بأن عدد ذرات العناصر في مركب معيّن موجود دائمًا بنفس النسبة يتوافق مع هذه الملاحظات. على سبيل المثال، عندما يتم تحليل عينات مختلفة من الأيزوكتان (أحد مكونات البنزين وأحد المعايير المستخدمة في نظام تصنيف الأوكتان)، وُجد أن نسبة كتلة الكربون إلى الهيدروجين هي 5.33: 1، كما هو موضح في الجدول 2.1.
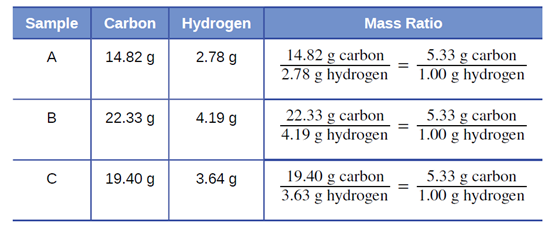
تجدر الإشارة إلى أنه على الرغم من أن جميع عينات مركّب معيّن لها نفس نسبة الكتلة، فإن العكس ليس صحيحًا بشكل عام. أي أن العينات التي لها نفس نسبة الكتلة ليست بالضرورة نفس المادة. على سبيل المثال، هناك العديد من المركّبات بخلاف الأيزوكتان التي لها أيضًا نسبة كتلة كربون إلى هيدروجين تبلغ 5.33: 1.00.
قانون النسب المتعددة في الذرات
استخدم دالتون أيضًا بيانات من بروست Prost، بالإضافة إلى نتائج تجاربه الخاصة، لصياغة قانون آخر مثير للاهتمام. ينص قانون النسب المتعددة Law of Multiple Proportions على أنه عندما يتفاعل عنصران لتكوين أكثر من مركب واحد، فإن الكتلة الثابتة لأحد العناصر ستتفاعل مع كتل العنصر الآخر بنسبة صغيرة عبارة عن أعداد صحيحة. على سبيل المثال، يمكن أن يشكل النحاس والكلور مادة صلبة بلورية خضراء مع نسبة كتلة 0.558 جم كلور إلى 1 جم نحاس، بالإضافة إلى مادة صلبة بلورية بنية بنسبة كتلة 1.116 جم كلور إلى 1 جم نحاس. قد لا تبدو هذه النسب في حد ذاتها مثيرة للاهتمام أو مفيدة بشكل خاص. ومع ذلك، إذا أخذنا نسبة من هذه النسب، فإننا نحصل على نتيجة مفيدة وربما مفاجئة: حيث أنها نسبة صغيرة من عدد صحيح.
(1.116 جرام كلور / 1 غرام نحاس) ÷ (0.558 جم كلور / 1 جرام نحاس) = 2 / 1 = 2
تعني نسبة 2 إلى 1 أن المركب البني يحتوي على ضعف كمية الكلور لكل كمية من النحاس مقارنة بالمركب الأخضر.
يمكن تفسير ذلك من خلال النظرية الذرية إذا كانت نسبة النحاس إلى الكلور في المركب البني هي 1 ذرة نحاس إلى 2 ذرة كلور، والنسبة في المركب الأخضر هي 1 ذرة نحاس إلى 1 ذرة كلور. وبالتالي فإن نسبة ذرات الكلور (وبالتالي نسبة كتلها) هي 2 إلى 1 (الشكل 2.5).
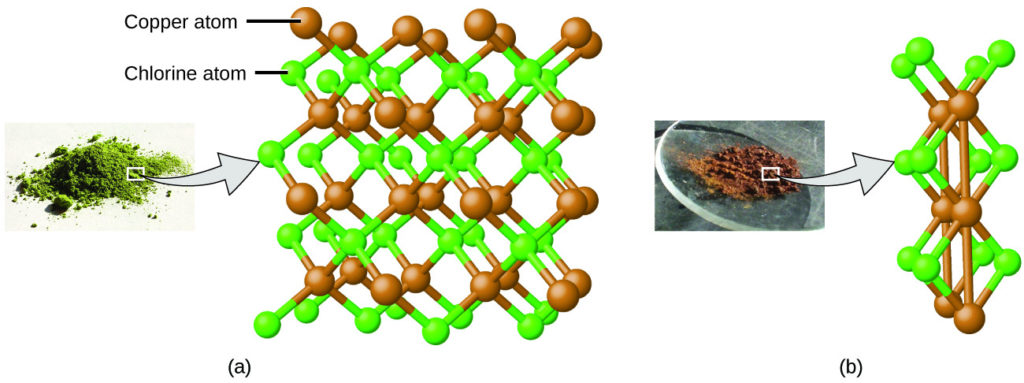
الشكل 2.5: مقارنة بمركب كلوريد النحاس في (a)، حيث يتم تمثيل النحاس بواسطة كرات بنية والكلور بواسطة كرات خضراء، يحتوي مركب كلوريد النحاس في (b) على ضعف عدد ذرات الكلور لكل ذرة نحاس. (المصدر: أ. بواسطة Benjah-bmm27/ ويكيميديا كومنز؛ ب. بواسطة Walkerma / ويكيميديا كومنز).
مثال 2.2: على قوانين النسب المحددة والمتعددة
تم تحليل عينة من المركب A (غاز شفاف عديم اللون) ووجد أنها تحتوي على 4.27 جم كربون و5.69 جم أكسجين. تم تحليل عينة من المركب B (أيضًا غاز شفاف عديم اللون) ووُجد أنها تحتوي على 5.19 جم كربون و13.84 جم أكسجين. هل هذه البيانات مثال على قانون النسب المحددة، قانون النسب المتعددة، أم لا؟ ماذا تخبرك هذه البيانات عن المادتين A وB؟
الحل:
في المركب A، نسبة كتلة الأكسجين إلى الكربون هي:
1.33 جرام أكسجين / 1 جرام كربون
في المركب B، نسبة كتلة الأكسجين إلى الكربون هي:
2.67 جرام أكسجين / 1 جرام كربون
النسبة بين هذه النسب هي:
(1.33 جرام أكسجين / 1 جرام كربون) ÷ (2.67 جرام أكسجين / 1 جرام كربون)
= 1 / 2
هذا يدعم قانون النسب المتعددة. هذا يعني أن A وB مركبان مختلفان، حيث يحتوي A على نصف كمية الكربون لكل كمية من الأكسجين (أو ضعف كمية الأكسجين لكل كمية من الكربون). مثلاً ممكن أن يكون المركب الأول هو ثاني أكسيد الكربون A = CO2 والمركب الثاني هو أول أكسيد الكربون B = CO.
تحقق من فهمك (تدريب)
تم تحليل عينة من المركب X (سائل شفاف، عديم اللون، قابل للاحتراق برائحة ملحوظة) ووُجد أنها تحتوي على 14.13 جم كربون و2.96 جم هيدروجين. تم تحليل عينة من المركب Y (سائل شفاف عديم اللون وقابل للاشتعال برائحة ملحوظة تختلف قليلاً عن رائحة X) ووجد أنها تحتوي على 19.91 جم كربون و3.34 جم هيدروجين. هل هذه البيانات مثال على قانون النسب المحددة، قانون النسب المتعددة، أم لا؟ ماذا تخبرك هذه البيانات عن المادتين X وY؟
الإجابة:
في المركب X، تبلغ نسبة كتلة الكربون إلى الهيدروجين 14.13 جم كربون / 2.96 هيدروجين.
في المركب Y، تبلغ نسبة كتلة الكربون إلى الهيدروجين 19.91 جم كربون / 3.34 جم هيدروجين.
النسبة بين هذه النسب = (14.13 / 2.96) ÷ (19.91 / 3.34) = = 4.77 / 5.96 = 0.800 = 4/5
تدعم هذه النسبة الصغيرة من العدد الصحيح قانون النسب المتعددة. هذا يعني أن X وY مركبان مختلفان.
المراجع
- مقرر الكيمياء، كلية OpenStax، إصدار سنة OpenStax College, Chemistry ،2015. الفصل الثاني: الذرات والجزيئات والأيونات.
- موسوعة الكيمياء من الألف إلى الياء، ترجمة وإعداد: د. م. مصطفى عبيد، مركز البحوث والدراسات متعدد التخصصات، إسطنبول، 2022-2023.