الأساس الكيميائي للحياة

الشكل 2.1: الذرات هي اللبنات الأساسية للجزيئات في الكون – الهواء والتربة والماء والصخور، وكذلك خلايا جميع الكائنات الحية. في هذا النموذج للجزيء العضوي، تكون ذرات الكربون (الأسود) والهيدروجين (الأبيض) والنيتروجين (الأزرق) والأكسجين (الأحمر) والفوسفور (الأصفر) ذات حجم ذري متناسب. تشير قضبان الفضة إلى الروابط الكيميائية. (المصدر: تعديل العمل من قبل كريستيان جوتييه) – الأساس الكيميائي للحياة – موسوعة علم الأحياء.
مخطط الفصل
- 2.1 الذرات والنظائر والأيونات والجزيئات: اللبنات الأساسية
- 2.2 الماء
- 2.3 الكربون
تشمل العناصر في مجموعات مختلفة كل المواد، بما في ذلك الكائنات الحية. تشمل بعض العناصر الأكثر وفرة في الكائنات الحية الكربون والهيدروجين والنيتروجين والأكسجين والكبريت والفوسفور. تشكل هذه الأحماض النووية والبروتينات والكربوهيدرات والدهون التي تعتبر المكونات الأساسية للمادة الحية. يجب أن يفهم علماء الأحياء هذه اللبنات الأساسية المهمة والهياكل الفريدة للذرات التي تتكون منها الجزيئات، مما يسمح بتكوين الخلايا والأنسجة وأنظمة الأعضاء والكائنات الحية بأكملها.
تتبع جميع العمليات البيولوجية قوانين الفيزياء والكيمياء، لذلك من أجل فهم كيفية عمل الأنظمة البيولوجية، من المهم فهم الفيزياء والكيمياء الكامنة. على سبيل المثال، يتبع تدفق الدم داخل الجهاز الدوري قوانين الفيزياء التي تنظم أنماط تدفق السوائل. إن تكسير الجزيئات الكبيرة والمعقدة من الطعام إلى جزيئات أصغر – وتحويلها لإطلاق طاقة لتخزينها في أدينوسين ثلاثي الفوسفات (ATP) – هو عبارة عن سلسلة من التفاعلات الكيميائية التي تتبع القوانين الكيميائية. تعتبر خصائص الماء وتكوين الروابط الهيدروجينية أساسية لفهم العمليات الحيوية. لذلك، فإن أساسيات الفيزياء والكيمياء مهمة لاكتساب نظرة ثاقبة للعمليات البيولوجية.
المحتويات
الذرات والنظائر والأيونات والجزيئات: اللبنات الأساسية
أهداف التعلم
بنهاية هذا القسم، ستكون قادرًا على القيام بما يلي:
- تعريف المادة والعناصر.
- وصف العلاقة المتبادلة بين البروتونات والنيوترونات والإلكترونات.
- المقارنة بين الطرق التي يمكن من خلالها التبرع بالإلكترونات أو مشاركتها بين الذرات.
- شرح الطرق التي تتحد بها العناصر التي تحدث بشكل طبيعي لتكوين الجزيئات والخلايا والأنسجة وأنظمة الأعضاء والكائنات الحية.
تتكون الحياة في أبسط مستوياتها من المادة. المادة هي أي شيء يشغل حيزًا وله كتلة. العناصر هي أشكال فريدة للمادة ذات خصائص كيميائية وفيزيائية معينة لا يمكن أن تتحلل إلى مواد أصغر من خلال التفاعلات الكيميائية العادية. هناك 118 عنصرًا، لكن 98 عنصرًا فقط تتواجد بشكل طبيعي. العناصر المتبقية غير مستقرة وتتطلب من العلماء تجميعها في المختبرات.
يتم تحديد كل عنصر برمزه الكيميائي، وهو حرف واحد كبير أو، عندما يكون الحرف الأول “مأخوذًا” بالفعل بواسطة عنصر آخر، مزيج من حرفين. تتبع بعض العناصر المصطلح الإنجليزي للعنصر، مثل C للكربون وCa للكالسيوم. الرموز الكيميائية للعناصر الأخرى مشتقة من أسمائها اللاتينية. على سبيل المثال، رمز الصوديوم هو Na، في إشارة إلى Natrium، الكلمة اللاتينية للصوديوم.
العناصر الأربعة المشتركة لجميع الكائنات الحية هي الأكسجين (O) والكربون (C) والهيدروجين (H) والنيتروجين (N). في العالم غير الحي، توجد العناصر بنسب مختلفة، كما أن بعض العناصر المشتركة للكائنات الحية نادرة نسبيًا على الأرض ككل، كما يوضح الجدول 2.1. على سبيل المثال، الغلاف الجوي غني بالنيتروجين والأكسجين ولكنه يحتوي على القليل من الكربون والهيدروجين، في حين أن قشرة الأرض، على الرغم من أنها تحتوي على الأكسجين وكمية صغيرة من الهيدروجين، إلا أنها تحتوي على القليل من النيتروجين والكربون. على الرغم من اختلافها في الوفرة، فإن جميع العناصر والتفاعلات الكيميائية بينها تخضع لنفس القوانين الكيميائية والفيزيائية بغض النظر عما إذا كانت جزءًا من العالم الحي أو غير الحي.
النسبة التقريبية للعناصر في الكائنات الحية (البشر) مقارنة بالعالم غير الحي
| الغلاف الجوي | الحياة (البشر) | الغلاف الجوي | قشرة الأرض |
| الأكسجين (O) | 65% | 21% | 46% |
| الكربون (C) | 18% | بقايا | بقايا |
| الهيدروجين (H) | 10% | بقايا | 0.1% |
| النيتروجين (N) | 3% | 78% | بقايا |
هيكل الذرة
لفهم كيفية تجميع العناصر معًا، يجب علينا أولاً مناقشة أصغر مكوّن أو لبنة بناء للعنصر، وهي الذرة. الذرة هي أصغر وحدة في المادة تحتفظ بجميع الخصائص الكيميائية للعنصر. على سبيل المثال، تحتوي ذرة ذهب واحدة على جميع خصائص الذهب، مثل تفاعلها الكيميائي. العملة الذهبية هي ببساطة عدد كبير جدًا من ذرات الذهب المصبوبة على شكل عملة معدنية وتحتوي على كميات صغيرة من العناصر الأخرى المعروفة باسم الشوائب. لا يمكننا تحطيم ذرات الذهب إلى أي شيء أصغر مع الاحتفاظ بخصائص الذهب.
تتكون الذرة من منطقتين: النواة Nucleus الموجودة في مركز الذرة وتحتوي على البروتونات والنيوترونات. تحافظ المنطقة الخارجية للذرة على إلكتروناتها في مدار Orbital حول النواة، كما يوضح الشكل 2.2. تحتوي الذرات على البروتونات والإلكترونات والنيوترونات، من بين الجسيمات دون الذرية الأخرى. أكثر نظائر الهيدروجين (H) شيوعًا هو الاستثناء الوحيد ويتكون من بروتون واحد وإلكترون واحد بدون نيوترونات.
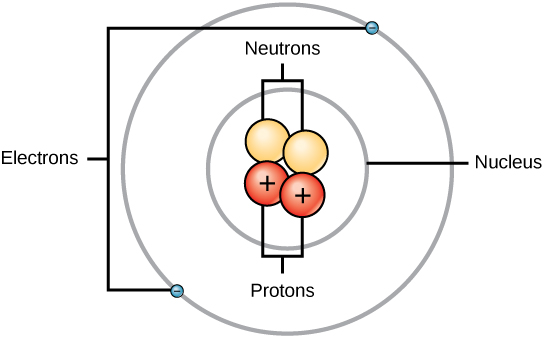
الشكل 2.2: العناصر، مثل الهليوم، الموصوفة هنا، تتكون من ذرات. تتكون الذرات من البروتونات والنيوترونات الموجودة داخل النواة، مع الإلكترونات في المدارات المحيطة بالنواة.
يوضح هذا الرسم التوضيحي أنه، مثل الكواكب التي تدور حول الشمس، تدور الإلكترونات حول نواة الذرة. تحتوي النواة على نيوترونين محايد الشحنة، واثنين من البروتونات موجبة الشحنة ممثلة بالكرات. يحتوي المدار الدائري الفردي المحيط بالنواة على إلكترونين سالبي الشحنة على الجانبين المتقابلين.
البروتونات والنيوترونات لها نفس الكتلة تقريبًا، حوالي 1.67 × 10 -24 جرامًا. يحدد العلماء بشكل تعسفي هذه الكمية من الكتلة كوحدة كتل ذرية واحدة (amu) أو وحدة دالتون واحدة، كما يوضح الجدول 2.2. على الرغم من تشابه البروتونات والنيوترونات في الكتلة، إلا أنها تختلف في شحنتها الكهربائية. البروتون Proton موجب الشحنة؛ في حين أن النيوترون Neutron غير مشحون. لذلك، فإن عدد النيوترونات في الذرة يساهم بشكل كبير في كتلتها، ولكن ليس في شحنتها. كتلة الإلكترونات Electrons أصغر بكثير من البروتونات، حيث تزن فقط 9.11 × 10 -28 جرام، أو حوالي 1/1800 من وحدة الكتل الذرية. ومن ثم، فهي لا تساهم كثيرًا في الكتلة الذرية الكلية للعنصر.
لذلك، عند التفكير في الكتلة الذرية، من المعتاد تجاهل كتلة أي إلكترونات وحساب كتلة الذرة بناءً على عدد البروتونات والنيوترونات وحدها. على الرغم من أن الإلكترونات ليست مساهمًا مهمًا في الكتلة، إلا أنها تساهم بشكل كبير في شحنة الذرة، حيث أن لكل إلكترون شحنة سالبة مساوية لشحنة البروتون الموجبة. في الذرات المحايدة غير المشحونة، يكون عدد الإلكترونات التي تدور حول النواة مساويًا لعدد البروتونات داخل النواة. في هذه الذرات، تلغي الشحنات الموجبة والسالبة بعضها البعض، مما يؤدي إلى ذرة بدون شحنة محصلة أو صافية.
نظرًا لأحجام البروتونات والنيوترونات والإلكترونات، فإن معظم حجم الذرة – أكبر من 99 في المائة منها – هو مساحة فارغة. مع كل هذه المساحة الفارغة، قد يتساءل المرء لماذا لا تمر الأشياء الصلبة المزعومة من خلال بعضها البعض. والسبب في عدم حدوث ذلك هو أن الإلكترونات التي تحيط بجميع الذرات مشحونة بشحنة سالبة والشحنات السالبة تتنافر.
البروتونات والنيوترونات والإلكترونات:
| الشحنة | الكتلة (وحدة كتل ذرية) | الموقع | |
| بروتون | +1 | 1 | النواة |
| نيوترون | صفر | 1 | النواة |
| إلكترون | -1 | صفر | المدارات حول النواة |
العدد الذري والكتلة
تحتوي ذرات كل عنصر على عدد مميز من البروتونات والإلكترونات. يحدد عدد البروتونات العدد الذري للعنصر Atomic Number، والذي يستخدمه العلماء لتمييز عنصر عن الآخر. عدد النيوترونات متغير، مما ينتج عنه نظائر Isotopes، وهي أشكال مختلفة من نفس الذرة والتي تختلف فقط في عدد النيوترونات التي تمتلكها. يحدد عدد البروتونات والنيوترونات معًا عدد الكتلة Mass Number للعنصر، كما يوضح الشكل 2.3. لاحظ أننا نتجاهل المساهمة الصغيرة للكتلة من الإلكترونات في حساب العدد الكتلي. يمكننا استخدام هذا التقريب للكتلة لحساب عدد النيوترونات بسهولة عن طريق طرح عدد البروتونات من العدد الكتلي. نظرًا لأن نظائر عنصر ما سيكون لها أعداد كتل مختلفة قليلاً، فإن العلماء أيضًا يحددون الكتلة الذرية، وهي المتوسط المحسوب لعدد الكتلة لنظائره التي تتواجد بشكل طبيعي. غالبًا ما يحتوي العدد الناتج على كسر. على سبيل المثال، الكتلة الذرية للكلور (Cl) هي 35.45 لأن الكلور يتكون من عدة نظائر، بعضها (معظمها) بكتلة ذرية 35 (17 بروتونًا و18 نيوترونًا) وبعضها بكتلة ذرية 37 (17 بروتونًا و20 نيوترونًا).
اتصال مرئي
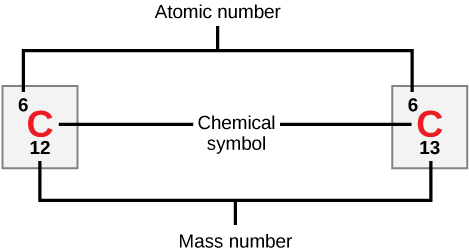
الشكل 2.3: للكربون عدد ذري قيمته ستة، ونظيران مستقران بأعداد كتلتهما اثني عشر وثلاثة عشر، على التوالي. كتلته الذرية النسبية هي 12.011.
يُشار إلى الكربون برمزه الذري، وهو حرف C كبير. يحتوي الكربون على العدد الذري ستة ونظيرين مستقرين، وهما الكربون carbon-12 والكربون carbon-13.
كم عدد النيوترونات التي يمتلكها الكربون carbon-12 والكربون carbon-13 على التوالي؟
النظائر
النظائر Isotopes هي أشكال مختلفة من عنصر لها نفس عدد البروتونات ولكن عددًا مختلفًا من النيوترونات. بعض العناصر – مثل الكربون والبوتاسيوم واليورانيوم – لها نظائر طبيعية. يحتوي الكربون 12 على ستة بروتونات وستة نيوترونات وستة إلكترونات. لذلك، لديها عدد كتلي 12 (ستة بروتونات وستة نيوترونات). يحتوي الكربون 14 على ستة بروتونات وثمانية نيوترونات وستة إلكترونات. كتلته الذرية هي 14 (ستة بروتونات وثمانية نيوترونات). هذان الشكلان البديلان للكربون هما نظائر. قد تصدر بعض النظائر النيوترونات والبروتونات والإلكترونات، وتحقق تكوينًا ذريًا أكثر استقرارًا (مستوى أقل من الطاقة الكامنة)؛ هذه هي النظائر المشعة أو Radioisotopes. يصف الاضمحلال الإشعاعي (تحلل الكربون -14 ليصبح في النهاية نيتروجين -14) فقدان الطاقة الذي يحدث عندما تطلق نواة ذرة غير مستقرة إشعاعًا.
اتصال التطور: تاريخ الكربون
يوجد الكربون عادة في الغلاف الجوي على شكل مركبات غازية مثل ثاني أكسيد الكربون والميثان. الكربون 14 (14C) هو نظير مشع طبيعي يتكون في الغلاف الجوي من نيتروجين الغلاف الجوي (14N) عن طريق إضافة نيوترون وفقدان بروتون بسبب الأشعة الكونية. هذه عملية مستمرة، لذلك يتم دائمًا إنشاء المزيد من 14C. نظرًا لأن الكائن الحي يشتمل على 14C في البداية كثاني أكسيد الكربون المثبت في عملية التمثيل الضوئي، فإن الكمية النسبية البالغة 14C في جسمه تساوي تركيز 14C في الغلاف الجوي. عندما يموت الكائن الحي، لم يعد يستوعب 14C، وبالتالي فإن النسبة بين 14C و12C سوف تقل حيث يتحلل 14C تدريجياً إلى 14N بواسطة عملية تسمى تحلل بيتا – انبعاث الإلكترونات أو البوزيترونات. هذا الاضمحلال يبعث الطاقة في عملية بطيئة.
بعد حوالي 5730 سنة، نصف تركيز 14C الأولي سوف يتحول مرة أخرى إلى 14N. نحن نسمي الوقت الذي يستغرقه نصف التركيز الأصلي للنظير حتى يتحلل مرة أخرى إلى شكله الأكثر استقرارًا باسم عمر النصف half-life.. نظرًا لأن عمر النصف لـ 14C طويل، يستخدمه العلماء لتأريخ الكائنات الحية سابقًا مثل العظام القديمة أو الخشب. بمقارنة نسبة تركيز 14C في جسم ما إلى كمية 14C في الغلاف الجوي، يمكن للعلماء تحديد كمية النظير الذي لم يتحلل بعد. على أساس هذا المقدار، الشكل 2.4 يوضح أنه يمكننا حساب عمر المادة، مثل الماموث الأقزام، بدقة إذا لم يكن أقدم بكثير من حوالي 50000 عام. العناصر الأخرى لها نظائر ذات عمر النصف مختلف. على سبيل المثال، (البوتاسيوم -40) 40K له عمر نصف 1.25 مليار سنة، و(يورانيوم 235) 235U له عمر النصف حوالي 700 مليون سنة. من خلال استخدام التأريخ الإشعاعي، يمكن للعلماء دراسة عمر الحفريات أو بقايا الكائنات المنقرضة الأخرى لفهم كيفية تطور الكائنات الحية من الأنواع السابقة.

الشكل 2.4: يمكن للعلماء تحديد عمر البقايا المحتوية على الكربون التي يقل عمرها عن 50000 عام، مثل هذا الماموث الأقزام، باستخدام التأريخ الكربوني. (المصدر: بيل فولكنر، NPS)
رابط تعليمي خارجي
لمعرفة المزيد حول الذرات والنظائر وكيفية التمييز بين نظير وآخر، قم بتشغيل المحاكاة.
الجدول الدوري
ينظم الجدول الدوري ويعرض عناصر مختلفة. قام الكيميائي الروسي ديمتري مينديليف (1834-1907) في عام 1869، الذي ابتكر الجدول بتجميع العناصر التي، على الرغم من كونها فريدة، تشترك في خصائص كيميائية معينة مع عناصر أخرى. تكون خصائص العناصر مسؤولة عن حالتها الفيزيائية في درجة حرارة الغرفة: قد تكون غازات أو مواد صلبة أو سوائل. تحتوي العناصر أيضًا على تفاعل كيميائي محدد، والقدرة على الاندماج والارتباط الكيميائي مع بعضها البعض.
في الجدول الدوري في الشكل 2.5، يتم تنظيم العناصر وعرضها وفقًا لعددها الذري ويتم ترتيبها في سلسلة من الصفوف والأعمدة بناءً على الخصائص الكيميائية والفيزيائية المشتركة. بالإضافة إلى توفير العدد الذري لكل عنصر، يعرض الجدول الدوري أيضًا الكتلة الذرية للعنصر. بالنظر إلى الكربون، على سبيل المثال، يظهر رمزه (C) واسمه، بالإضافة إلى العدد الذري ستة (في الزاوية اليسرى العليا) وكتلته الذرية 12.01.
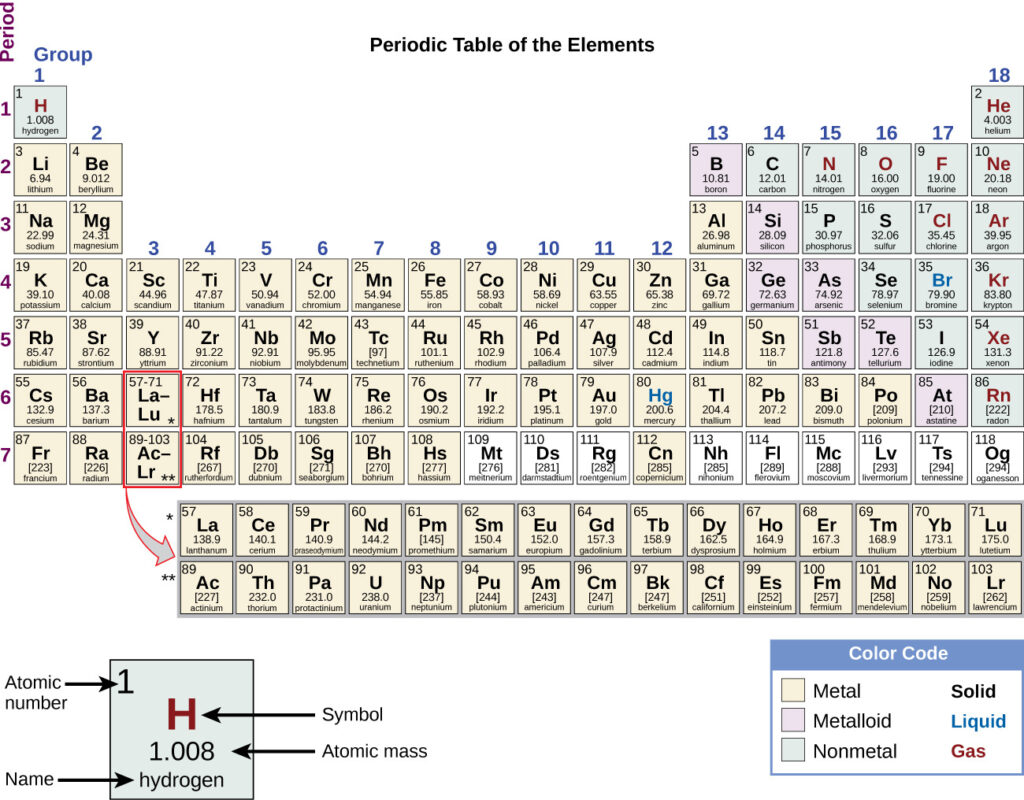
الشكل 2.5 يوضح الجدول الدوري الكتلة الذرية والعدد الذري لكل عنصر. يظهر الرقم الذري أعلى رمز العنصر وتظهر الكتلة الذرية التقريبية تحته.
يتكون الجدول الدوري من ثمانية عشر مجموعة وسبع فترات. كل عنصر له مربعه الخاص. داخل كل مربع توجد المعلومات التالية: العدد الذري والرمز والكتلة الذرية النسبية والاسم. على سبيل المثال، العدد الذري للهيدروجين هو 1، والرمز هو الحرف H، الكتلة الذرية النسبية 1.01 والاسم هيدروجين.
يقوم الجدول الدوري بتجميع العناصر وفقًا للخصائص الكيميائية. يبني العلماء الاختلافات في التفاعل الكيميائي بين العناصر على عدد إلكترونات الذرة وتوزيعها المكاني. الذرات التي تتفاعل كيميائيًا وتترابط مع بعضها البعض تشكل جزيئات. الجزيئات هي ببساطة ذرتان أو أكثر مرتبطتان كيميائيًا معًا. منطقيًا، عندما تترابط ذرتان كيميائيًا لتشكيل جزيء، فإن إلكتروناتها، التي تشكل المنطقة الخارجية لكل ذرة، تتجمع أولاً عندما تشكل الذرات رابطة كيميائية.
مدارات الإلكترون ونموذج بوهر
لاحظ أن هناك علاقة بين عدد البروتونات في العنصر، والعدد الذري الذي يميز عنصرًا عن الآخر، وعدد الإلكترونات الموجودة فيه. في جميع الذرات المحايدة كهربائيًا، يكون عدد الإلكترونات هو نفسه عدد البروتونات. وهكذا، فإن كل عنصر، على الأقل عندما يكون محايدًا كهربائيًا، له عدد مميز من الإلكترونات يساوي عددها الذري.
في عام 1913، طور العالم الدنماركي نيلز بوهر (1885-1962) نموذجًا مبكرًا للذرة. يُظهر نموذج بوهر الذرة كنواة مركزية تحتوي على البروتونات والنيوترونات، مع وجود الإلكترونات في مدارات دائرية Orbitals على مسافات محددة من النواة، كما يوضح الشكل 2.6. تشكل هذه المدارات قذائف إلكترونية أو مستويات طاقة، وهي طريقة لتصور عدد الإلكترونات في الأصداف الخارجية. يتم تحديد مستويات الطاقة هذه برقم ورمز “n”. على سبيل المثال، يمثل 1n أول مستوى للطاقة يقع بالقرب من النواة.
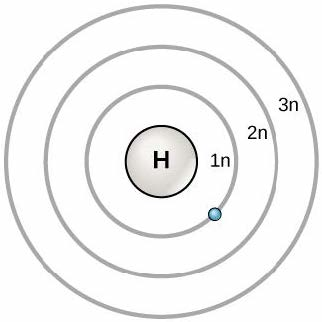
الشكل 2.6: في عام 1913، طور نيلز بوهر نموذج بوهر الذي توجد فيه الإلكترونات داخل المدارات الرئيسية. يوجد الإلكترون عادةً في أقل غلاف طاقة متاح، وهو الأقرب إلى النواة. يمكن أن تصطدم الطاقة من فوتون من الضوء بقذيفة طاقة أعلى، لكن هذا الوضع غير مستقر، والإلكترون يتحلل بسرعة إلى الحالة الأرضية. في هذه العملية، يطلق فوتونًا ضوئيًا.
تملأ الإلكترونات المدارات بترتيب ثابت: تملأ أولاً المدارات الأقرب للنواة، ثم تستمر في ملء مدارات الطاقة المتزايدة بعيدًا عن النواة. إذا كانت هناك مدارات متعددة ذات طاقة متساوية، فإنها تمتلئ بإلكترون واحد في كل مستوى طاقة قبل إضافة إلكترون ثان. تحدد الإلكترونات الموجودة في أقصى مستوى للطاقة استقرار طاقة الذرة وميلها إلى تكوين روابط كيميائية مع الذرات الأخرى لتكوين جزيئات.
في ظل الظروف القياسية، تملأ الذرات المدارات أو الأغلفة الداخلية أولاً، مما يؤدي غالبًا إلى عدد متغير من الإلكترونات في الغلاف الخارجي. تحتوي القشرة الداخلية على إلكترونين كحد أقصى، لكن يمكن أن تحتوي كل من غلافي الإلكترون التاليين على ثمانية إلكترونات كحد أقصى. يُعرف هذا بقاعدة الثمانيات، والتي تنص، باستثناء الغلاف الداخلي، على أن الذرات تكون أكثر ثباتًا من حيث الطاقة عندما يكون لديها ثمانية إلكترونات في غلاف التكافؤ، وهو الغلاف الخارجي للإلكترون. يوضح الشكل 2.7 أمثلة لبعض الذرات المحايدة وتكوينات الإلكترون الخاصة بها. لاحظ ذلك في الشكل 2.7، الهليوم له غلاف إلكترون خارجي كامل، مع إلكترونين يملآن غلافه الأول والوحيد. وبالمثل، يحتوي النيون على غلاف خارجي 2n كامل يحتوي على ثمانية إلكترونات. في المقابل، يحتوي كل من الكلور والصوديوم على سبعة وواحد في غلافهما الخارجي، على التوالي، ولكن من الناحية النظرية سيكونان أكثر استقرارًا من حيث الطاقة إذا اتبعوا قاعدة الثمانيات وكان لديهم ثمانية.
اتصال مرئي: مخططات بوهر
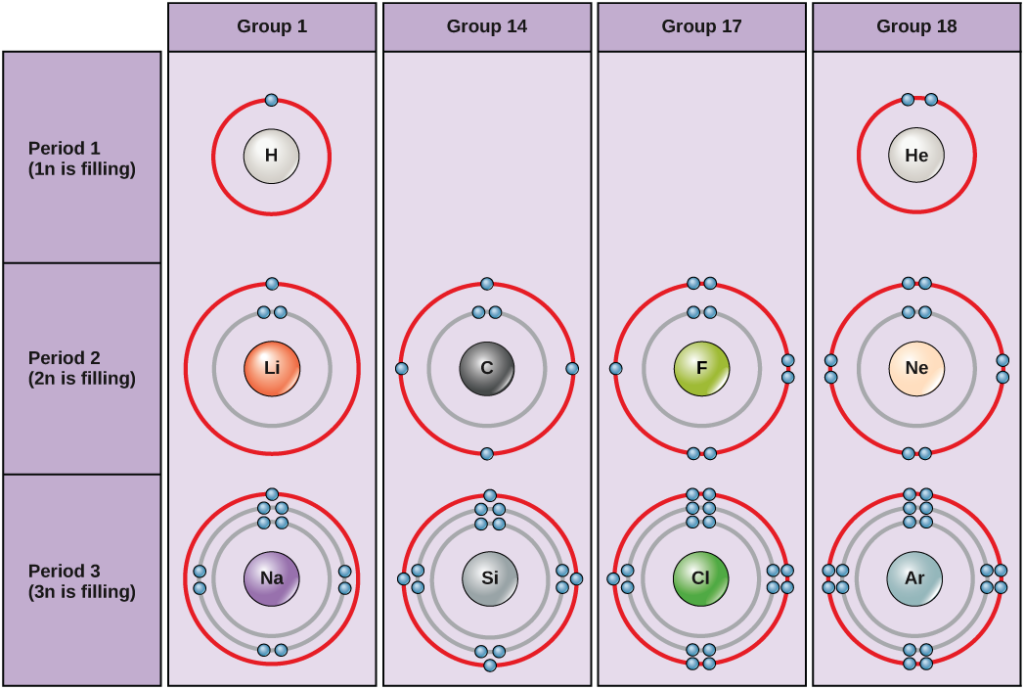
شكل 2.7: يوضح مخططات بوهر عدد الإلكترونات التي تملأ كل مدار رئيسي. تحتوي عناصر المجموعة 18 (الهيليوم والنيون والأرجون) على غلاف خارجي كامل أو غلاف تكافؤ Valence. غلاف التكافؤ الكامل هو تكوين الإلكترون الأكثر استقرارًا. تملأ العناصر في مجموعات أخرى أغلفة التكافؤ جزئيًا وتكتسب أو تفقد إلكترونات لتحقيق تكوين إلكتروني مستقر.
قد تعطي الذرة أو تأخذ أو تشارك الإلكترونات مع ذرة أخرى لتحقيق غلاف تكافؤ كامل، وهو تكوين الإلكترون الأكثر استقرارًا. بالنظر إلى هذا الشكل، كم عدد الإلكترونات التي يجب أن تخسرها عناصر المجموعة 1 من أجل تحقيق تكوين إلكتروني مستقر؟ كم عدد الإلكترونات التي تحتاج العناصر في المجموعتين 14 و17 إلى اكتسابها لتحقيق تكوين إلكتروني مستقر؟
إن فهم أن تنظيم الجدول الدوري يعتمد على العدد الإجمالي للبروتونات (والإلكترونات) يساعدنا على معرفة كيفية توزيع الإلكترونات بين المستويات (أو المدارات أو الأصداف). يتم ترتيب الجدول الدوري في أعمدة وصفوف بناءً على عدد الإلكترونات وموقعها. افحص عن كثب بعض العناصر الموجودة في العمود الأيمن الأقصى للجدول في الشكل 2.5. المجموعة 18 ذرات هيليوم (He) ونيون (Ne) والأرجون (Ar) ملأت جميعها قذائف إلكترونية خارجية، مما يجعل من غير الضروري بالنسبة لها مشاركة الإلكترونات مع ذرات أخرى لتحقيق الاستقرار. فهي مستقرة للغاية مثل الذرات المفردة. نظرًا لأنها غير تفاعلية، يقوم العلماء بصكها خاملة (أو غازات نبيلة). قارن هذا بعناصر المجموعة 1 في العمود الأيسر. تحتوي هذه العناصر، بما في ذلك الهيدروجين (H) والليثيوم (Li) والصوديوم (Na)، على إلكترون واحد في غلافها الخارجي.
هذا يعني أنه يمكنهم تحقيق تكوين مستقر وقشرة خارجية مملوءة عن طريق التبرع أو مشاركة إلكترون واحد مع ذرة أخرى أو جزيء مثل الماء. سوف يتبرع الهيدروجين أو يشارك الإلكترون الخاص به لتحقيق هذا التكوين، بينما سيتبرع الليثيوم والصوديوم بإلكترونهم ليصبحوا مستقرين. نتيجة لفقدان إلكترون سالب الشحنة، تصبح أيونات موجبة الشحنة. تحتوي عناصر المجموعة 17، بما في ذلك الفلور والكلور، على سبعة إلكترونات في غلافها الخارجي، لذا فهي تميل إلى ملء هذه الغلاف بإلكترون من ذرات أو جزيئات أخرى، مما يجعلها أيونات سالبة الشحنة. تحتوي عناصر المجموعة 14، والتي يعتبر الكربون أهمها للأنظمة الحية، على أربعة إلكترونات في غلافها الخارجي مما يتيح لها تكوين عدة روابط تساهمية covalent bonds (سوف نناقشها لاحقًا) مع ذرات أخرى. وبالتالي، تمثل أعمدة الجدول الدوري الحالة المشتركة المحتملة لأغلفة الإلكترون الخارجية لهذه العناصر المسؤولة عن خصائصها الكيميائية المتشابهة.
مدارات الإلكترونات
على الرغم من أنه مفيد في شرح التفاعل والترابط الكيميائي لعناصر معينة، إلا أن نموذج بوهر لا يعكس بدقة كيفية توزيع الإلكترونات لنفسها مكانيًا حول النواة. إنها لا تدور حول النواة كما تدور الأرض حول الشمس، لكننا نجدها في مدارات الإلكترون. تنتج هذه الأشكال المعقدة نسبيًا عن حقيقة أن الإلكترونات لا تتصرف مثل الجسيمات فحسب، بل تتصرف أيضًا مثل الموجات. المعادلات الرياضية من ميكانيكا الكم، والتي يسميها العلماء وظائف الموجة، يمكن أن تتنبأ ضمن مستوى معين من الاحتمال أين يمكن أن يكون الإلكترون في أي وقت. يطلق العلماء على المنطقة التي يرجح أن يوجد فيها الإلكترون اسم “مدار الإلكترون” Orbital.
تذكر أن نموذج بوهر يصور تكوين غلاف إلكترون للذرة. يوجد داخل كل غلاف إلكتروني قشرة فرعية، ولكل قشرة فرعية عدد محدد من المدارات التي تحتوي على إلكترونات. في حين أنه من المستحيل حساب موقع الإلكترون بالضبط، يعرف العلماء أنه على الأرجح يقع داخل مساره المداري. تشير الأحرف s وp وd وf إلى الأجزاء الفرعية. القشرة الفرعية s كروية الشكل ولها مدار واحد. تحتوي القشرة الرئيسية 1n على مدار s واحد فقط، والذي يمكنه حمل إلكترونين. الغلاف الرئيسي 2n يحتوي على قشرة فرعية واحدة s وواحدة p، ويمكن أن تحتوي على إجمالي ثمانية إلكترونات. تحتوي الطبقة الفرعية p على ثلاثة مدارات على شكل دمبل، كما يوضح الشكل 2.8. تحتوي الطبقات الفرعية d وf على أشكال أكثر تعقيدًا وتحتوي على خمسة وسبعة مدارات، على التوالي. نحن لا نظهر هذه في الرسم التوضيحي. الغلاف الرئيسي 3n يحتوي على قشرة فرعية s وp وd ويمكنه استيعاب 18 إلكترونًا. الغلاف الرئيسي 4n يحتوي على المدارات s وp وd وf ويمكن أن يحمل 32 إلكترونًا. بالابتعاد عن النواة، يزداد عدد الإلكترونات والمدارات في مستويات الطاقة. بالتقدم من ذرة إلى أخرى في الجدول الدوري، يمكننا تحديد بنية الإلكترون عن طريق تركيب إلكترون إضافي في المدار التالي المتاح.
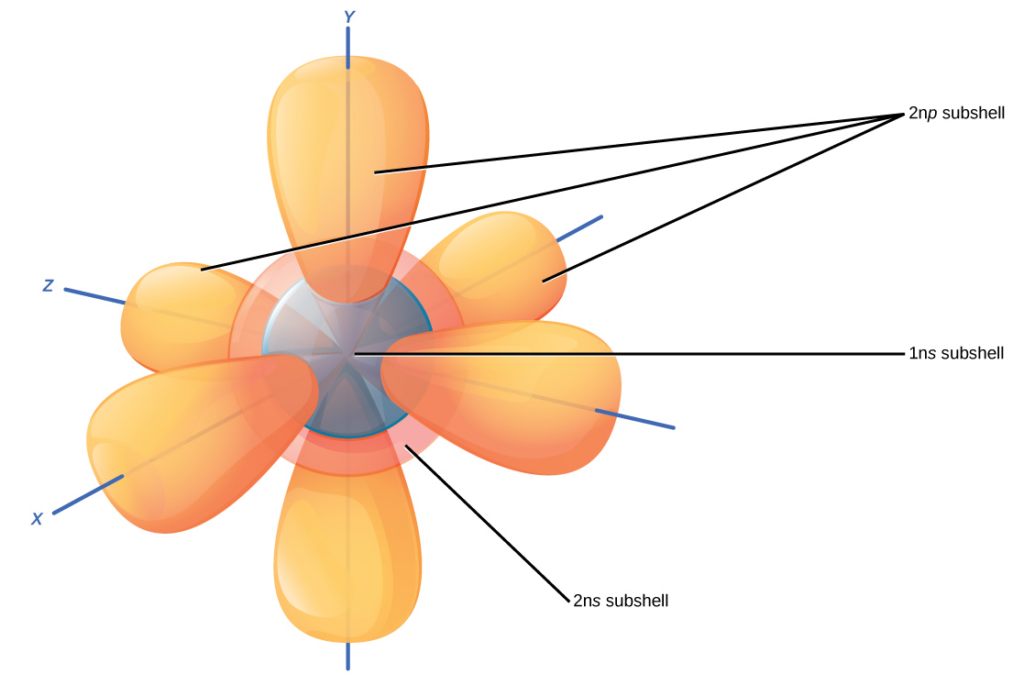
شكل 2.8: الأجزاء الفرعية s تتشكل مثل الكرات. كل من المدارات الرئيسية 1n و2n لها مدار s، لكن حجم الكرة أكبر في المدار 2n. كل كرة هي مدار واحد. ثلاثة مدارات على شكل دمبل تتكون من مدارات فرعية. المدار الرئيسي 2n له مدار فرعي p، لكن المدار 1 ليس له.
أقرب مدار للنواة، المدار 1s، يمكنه استيعاب ما يصل إلى إلكترونين. هذا المدار يعادل غلاف الإلكترون الداخلي لنموذج بوهر. المدار 1s هو أقرب مدار للنواة، ويتم ملؤه دائمًا أولاً، قبل أي حشوات مدارية أخرى. يحتوي الهيدروجين على إلكترون واحد. لذلك، فإنه يحتل مكانًا واحدًا فقط داخل مدار 1s. نعيّن هذا على أنه 1s1، حيث يشير الرقم 1 المرتفع إلى الإلكترون الواحد داخل مدار 1s. الهليوم له إلكترونان. لذلك، يمكنه ملء مدار 1s بالكامل بإلكترونيه. نحدد هذا على أنه 1s2، مشيرًا إلى إلكترونين من الهيليوم في المدار 1s. في الجدول الدوري، شكل 2.5، الهيدروجين والهيليوم هما العنصران الوحيدان في الصف الأول (الفترة). هذا لأن لديهم إلكترونات فقط في غلافهم الأول، مدار 1s. الهيدروجين والهيليوم هما العنصران الوحيدان اللذان لهما 1s وليس لهما مدارات إلكترونية أخرى في الحالة المحايدة كهربائيًا.
قد يحتوي غلاف الإلكترون الثاني على ثمانية إلكترونات. تحتوي هذه القذيفة على مدارين كرويين آخرين وثلاثة مدارات p على شكل “دمبل”، كل منها يمكن أن يحمل إلكترونين، كما يوضح الشكل 2.8. بعد امتلاء المدار 1s، تملأ قذيفة الإلكترون الثانية، أولاً تملأ مداراتها 2s ثم مداراتها 3p. عند ملء المدارات p، يأخذ كل منها إلكترونًا واحدًا. بمجرد أن يحتوي كل مدار p على إلكترون، فقد يضيف إلكترون ثانِ. يحتوي الليثيوم (Li) على ثلاثة إلكترونات تشغل الغلافين الأول والثاني. يملأ إلكترونان المدار 1s، ثم يملأ الإلكترون الثالث المدار 2s. تكوين الإلكترون الخاص به هو 1s22s1. بدلاً من ذلك، يحتوي النيون (Ne) على ما مجموعه عشرة إلكترونات: اثنان في مداره الأول 1s وثمانية يملأ غلافه الثاني (اثنان في كل من المدارات 2s و3p). وبالتالي فهو غاز خامل ومستقر بقوة كذرة واحدة ونادرًا ما تشكل رابطة كيميائية مع ذرات أخرى. العناصر الأكبر لها مدارات إضافية، تتكون من غلاف الإلكترون الثالث. بينما ترتبط مفاهيم الأصداف الإلكترونية والمدارات ارتباطًا وثيقًا، توفر المدارات تصويرًا أكثر دقة لتكوين إلكترون الذرة لأن النموذج المداري يحدد الأشكال المختلفة والتوجهات الخاصة لجميع الأماكن التي قد تشغلها الإلكترونات.
رابط تعليمي خارجي
شاهد هذه الرسوم المتحركة المرئية لترى الترتيب المكاني لمداري p وs.
التفاعلات الكيميائية والجزيئات
تكون جميع العناصر أكثر ثباتًا عندما تمتلئ غلافها الخارجي بالإلكترونات وفقًا لقاعدة الثمانيات. هذا لأنه من المفضل بقوة أن تكون الذرات في هذا التكوين وتجعلها مستقرة. ومع ذلك، نظرًا لأنه لا تحتوي جميع العناصر على ما يكفي من الإلكترونات لملء غلافها الخارجي، فإن الذرات تشكل روابط كيميائية مع ذرات أخرى وبالتالي الحصول على الإلكترونات التي تحتاجها لتحقيق تكوين إلكتروني ثابت. عندما ترتبط ذرتان أو أكثر كيميائيًا ببعضهما البعض، فإن التركيب الكيميائي الناتج هو جزيء. يتكون جزيء الماء المألوف، H2O، من ذرتين من الهيدروجين وذرة أكسجين. تترابط هذه الذرات معًا لتكوين جزيء الماء، كما يوضح الشكل 2.9. يمكن للذرات تكوين جزيئات عن طريق التبرع بالإلكترونات أو قبولها أو مشاركتها لملء غلافها الخارجي.
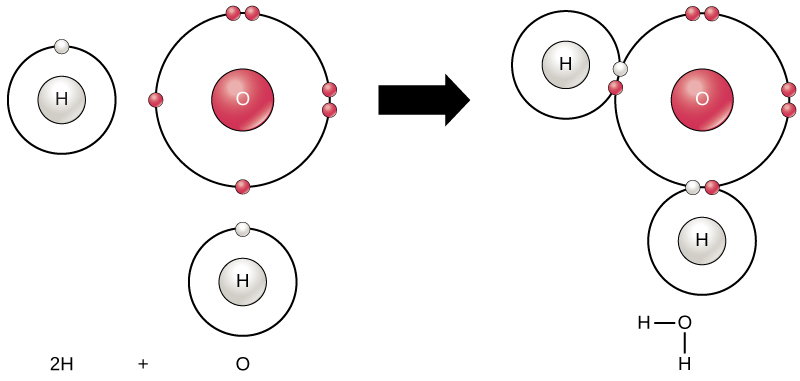
الشكل 2.9: قد تترابط ذرتان أو أكثر مع بعضهما البعض لتكوين جزيء. عندما يتشارك اثنان من الهيدروجين والأكسجين الإلكترونات عبر الروابط التساهمية، فإنه يشكل جزيء ماء.
في الصورة الأولى، تظهر ذرة الأكسجين بستة إلكترونات تكافؤ. تشكل أربعة من إلكترونات التكافؤ أزواجًا في الجانبين العلوي والأيمن من غلاف التكافؤ. الإلكترونان الآخران وحدهما في الجانبين السفلي والأيسر. توجد ذرة الهيدروجين بجانب كل إلكترون وحيد للأكسجين. يحتوي كل هيدروجين على إلكترون تكافؤ واحد فقط. يشير السهم إلى حدوث رد فعل. بعد التفاعل، في الصورة الثانية، ينضم كل إلكترون غير مزدوج في الأكسجين إلى إلكترون من إحدى ذرات الهيدروجين بحيث تكون حلقات التكافؤ متصلة ببعضها الآن. يمكن أيضًا تمثيل الرابطة التي تتكون بين الأكسجين والهيدروجين بعلامة شرطة.
تحدث التفاعلات الكيميائية Chemical reactions عندما تترابط ذرتان أو أكثر معًا لتكوين جزيئات أو عندما تتفكك الذرات المترابطة. يطلق العلماء على المواد المستخدمة في بداية التفاعل الكيميائي اسم المتفاعلات (عادةً تكون على الجانب الأيسر من المعادلة الكيميائية)، ونطلق على المواد الناتجة في نهاية التفاعل اسم نواتج التفاعل (عادةً تكون في الجانب الأيمن من المعادلة الكيميائية). نرسم عادةً سهمًا بين المواد المتفاعلة والمواد الناتجة للإشارة إلى اتجاه التفاعل الكيميائي. هذا الاتجاه ليس دائمًا “طريقًا باتجاه واحد”. لإنشاء جزيء الماء أعلاه، ستكون المعادلة الكيميائية كما يلي:
2H + O→ H2O
مثال على تفاعل كيميائي بسيط هو تكسير جزيئات بيروكسيد الهيدروجين، كل منها يتكون من ذرتين هيدروجين مرتبطتين بذرتين من الأكسجين (H2O2). يتحلل بيروكسيد الهيدروجين المتفاعل إلى ماء، ويحتوي على ذرة أكسجين مرتبطة بذرتين من الهيدروجين (H2O)، والأكسجين، والذي يتكون من ذرتين من الأكسجين المترابطين (O2). في المعادلة أدناه، يشتمل التفاعل على جزيئين من بيروكسيد الهيدروجين وجزيئين من الماء. هذا مثال على معادلة كيميائية متوازنة، حيث يكون عدد ذرات كل عنصر هو نفسه في كل جانب من المعادلة. وفقًا لقانون حفظ المادة، يجب أن يكون عدد الذرات قبل وبعد التفاعل الكيميائي متساويًا، بحيث لا يتم تكوين أو تدمير أي ذرات في الظروف العادية.
2H2O2 (hydrogen peroxide) → 2H2O (water) + O2 (oxygen)
على الرغم من أن جميع المواد المتفاعلة ونواتج هذا التفاعل عبارة عن جزيئات (تظل كل ذرة مرتبطة بذرة واحدة أخرى على الأقل)، في هذا التفاعل فقط بيروكسيد الهيدروجين والماء يمثلان مركبات: تحتويان على ذرات من أكثر من نوع واحد من العناصر. يتألف جزيء الأكسجين (الأكسجين الجزيئي)، بدلاً من ذلك، كما يوضح الشكل 2.10، من ذرتين أكسجين مرتبطين بشكل مزدوج ولا يُصنف كمركب ولكن كجزيء متجانس النواة.
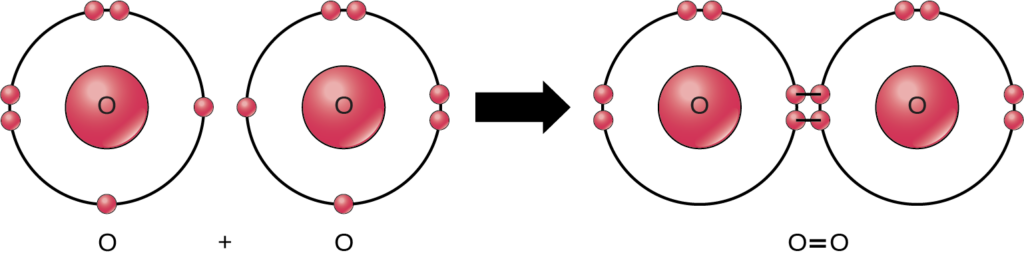
شكل 2.10: رابطة مزدوجة تنضم إلى ذرات الأكسجين في جزيء الأكسجين O2.
يمكن لبعض التفاعلات الكيميائية، مثل تلك المذكورة أعلاه، أن تستمر في اتجاه واحد حتى تستهلك جميع المواد المتفاعلة. المعادلات التي تصف هذه التفاعلات تحتوي على سهم أحادي الاتجاه ولا رجعة فيه. التفاعلات العكسية هي تلك التي يمكن أن تذهب في أي اتجاه. في التفاعلات العكسية، تتحول المواد المتفاعلة إلى نواتج، ولكن عندما يتجاوز تركيز المنتج حدًا معينًا (سمة من سمات تفاعل معين)، فإن بعض هذه النواتج تتحول مرة أخرى إلى مواد متفاعلة. في هذه المرحلة، تنعكس تسميات النواتج والمتفاعلات. يستمر هذا ذهابًا وإيابًا حتى يحدث توازن نسبي معين بين المواد المتفاعلة والنواتج – حالة تسمى التوازن. غالبًا ما تشير المعادلة الكيميائية ذات السهم المزدوج الذي يشير إلى المواد المتفاعلة والنواتج إلى تلك الحالات من التفاعل القابلة للعكس.
على سبيل المثال، في دم الإنسان، ترتبط أيونات الهيدروجين الزائدة (H+) بأيونات البيكربونات (HCO3–) لتشكل حالة توازن مع حمض الكربونيك (H2CO3). إذا أضفنا حمض الكربونيك إلى هذا النظام، فسيتحول بعضه إلى بيكربونات وأيونات الهيدروجين.
HCO3− + H+ ↔ H2CO3
ومع ذلك، نادرًا ما تحصل التفاعلات البيولوجية على توازن لأن تركيزات المواد المتفاعلة أو النواتج أو كليهما تتغير باستمرار، وغالبًا ما يكون مع ناتج تفاعل واحد مادة متفاعلة لآخر. بالعودة إلى مثال أيونات الهيدروجين الزائدة في الدم، سيكون تكوين حمض الكربونيك هو الاتجاه الرئيسي للتفاعل. ومع ذلك، يمكن لحمض الكربونيك أيضًا أن يترك الجسم كغاز ثاني أكسيد الكربون (عن طريق الزفير) بدلاً من التحول مرة أخرى إلى أيون البيكربونات، مما يؤدي إلى التفاعل باتجاه اليمين بموجب قانون التأثير الجماعي. هذه التفاعلات مهمة للحفاظ على التوازن في دمائنا.
HCO3− + H+ ↔ H2CO3 ↔ CO2 + H2O
الأيونات والروابط الأيونية
تكون بعض الذرات أكثر استقرارًا عندما تكتسب أو تفقد إلكترونًا (أو ربما اثنين) وتشكل أيونات Ions. هذا يملأ غلافها الإلكتروني الخارجي ويجعلها أكثر استقرارًا من الناحية النشطة. نظرًا لأن عدد الإلكترونات لا يساوي عدد البروتونات، فلكل أيون شحنة صافية. الكاتيونات Cations هي أيونات موجبة تتشكل بفقدان الإلكترونات. تتشكل الأيونات السالبة باكتساب الإلكترونات، والتي نسميها الأنيونات Anions. نقوم بتعيين الأنيونات من خلال اسمها الأولي وتغيير النهاية إلى “-ide”، وبالتالي فإن أنيون الكلور هو الكلوريد Chloride، وأنيون الكبريت هو الكبريتيد Sulfide.
يشير العلماء إلى حركة الإلكترونات هذه من عنصر إلى آخر على أنها نقل الإلكترون. كما في الشكل 2.11 الذي يوضح أن الصوديوم (Na) يحتوي فقط على إلكترون واحد في غلافه الإلكتروني الخارجي. يحتاج الصوديوم إلى طاقة أقل للتبرع بهذا الإلكترون الواحد مما يتطلبه لقبول سبعة إلكترونات أخرى لملء الغلاف الخارجي (بثمانية إلكترونات). إذا فقد الصوديوم إلكترونًا، فإنه يحتوي الآن على 11 بروتونًا و11 نيوترونًا و10 إلكترونات فقط، مما يتركه بشحنة إجمالية قدرها +1. نشير إليه الآن على أنه أيون الصوديوم. يحتوي الكلور (Cl) في أقل حالة طاقة له (تسمى الحالة الأرضية) على سبعة إلكترونات في غلافه الخارجي. مرة أخرى، يعتبر اكتساب الكلور إلكترونًا واحدًا أكثر كفاءة في استخدام الطاقة من خسارة سبعة إلكترونات. لذلك، فإنه يميل إلى اكتساب إلكترون لتكوين أيون مكون من 17 بروتونًا و17 نيوترونًا و18 إلكترونًا، مما يمنحه صافي شحنة سالبة (–1). نشير إليه الآن على أنه أيون كلوريد.
في هذا المثال، سيتبرع الصوديوم بإلكترون واحد لتفريغ غلافه، وسيقبل الكلور هذا الإلكترون لملء غلافه. يلبي كل من الأيونات الآن قاعدة الثمانيات ولهما أغلفة خارجية كاملة. نظرًا لأن عدد الإلكترونات لم يعد مساويًا لعدد البروتونات، فإن كل منها أصبح الآن أيونًا وله شحنة +1 (كاتيون الصوديوم) أو -1 (أنيون الكلوريد). لاحظ أن هذه المعاملات لا يمكن أن تتم إلا في وقت واحد: لكي تفقد ذرة الصوديوم إلكترونًا، يجب أن تكون في وجود متلقي مناسب مثل ذرة الكلور.
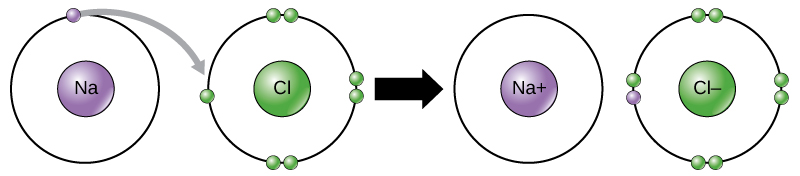
شكل 2.11: في تكوين مركب أيوني، تفقد المعادن الإلكترونات وتكتسب اللافلزات إلكترونات لتحقيق قاعدة الثمانيات.
تتشكل الروابط الأيونية Ionic bonds بين الأيونات ذات الشحنات المتعاكسة. على سبيل المثال، تترابط أيونات الصوديوم موجبة الشحنة وأيونات الكلوريد سالبة الشحنة معًا لتكوين بلورات من كلوريد الصوديوم، أو ملح الطعام، مما يؤدي إلى تكوين جزيء بلوري بدون شحنة صافية.
يشير علماء الفسيولوجيا إلى بعض الأملاح على أنها إلكتروليتات Electrolytes (بما في ذلك الصوديوم والبوتاسيوم والكالسيوم) والأيونات اللازمة لتوصيل النبضات العصبية وتقلصات العضلات وتوازن الماء. توفر العديد من المشروبات الرياضية والمكملات الغذائية هذه الأيونات لتعويض تلك المفقودة من الجسم عن طريق التعرق أثناء التمرين.
الروابط التساهمية والروابط والتفاعلات الأخرى
هناك طريقة أخرى للوفاء بقاعدة الثمانيات وهي مشاركة الإلكترونات بين الذرات لتكوين روابط تساهمية Covalent Bonds. هذه الروابط أقوى وأكثر شيوعًا من الروابط الأيونية في جزيئات الكائنات الحية. عادة ما نجد الروابط التساهمية في الجزيئات العضوية القائمة على الكربون، مثل الحمض النووي والبروتينات. نجد أيضًا روابط تساهمية في جزيئات غير عضوية مثل الماء H2O وثاني أكسيد الكربون CO2 والأكسجين O2. قد تشترك الروابط في زوج واحد أو اثنين أو ثلاثة أزواج من الإلكترونات، مما يؤدي إلى تكوين روابط مفردة ومزدوجة وثلاثية على التوالي. كلما زادت الروابط التساهمية بين ذرتين، كان ارتباطهما أقوى. وبالتالي، فإن الروابط الثلاثية هي الأقوى.
تُعد قوة المستويات المختلفة من الترابط التساهمي أحد الأسباب الرئيسية التي تجعل الكائنات الحية تواجه صعوبة في الحصول على النيتروجين لاستخدامه في بناء جزيئاتها، على الرغم من أن النيتروجين الجزيئي، N2، هو الغاز الأكثر وفرة في الغلاف الجوي. يتكون النيتروجين الجزيئي من ذرتين من النيتروجين مترابطتين مع بعضهما البعض، وكما هو الحال مع جميع الجزيئات، فإن مشاركة هذه الأزواج الثلاثة من الإلكترونات بين ذرتي النيتروجين تسمح بملء غلاف الإلكترون الخارجي، مما يجعل الجزيء أكثر استقرارًا من ذرات النيتروجين الفردية. هذه الرابطة الثلاثية القوية تجعل من الصعب على الأنظمة الحية تفكيك هذا النيتروجين من أجل استخدامه كمكونات للبروتينات والحمض النووي.
يوفر تكوين جزيئات الماء مثالاً على الترابط التساهمي. تربط الروابط التساهمية ذرات الهيدروجين والأكسجين التي تتحد لتشكل جزيئات الماء كما يوضح الشكل 2.9. يقسم الإلكترون من الهيدروجين وقته بين الغلاف الخارجي غير المكتمل لذرات الهيدروجين والغلاف الخارجي غير المكتمل لذرات الأكسجين. لملء الغلاف الخارجي للأكسجين بالكامل، والذي يحتوي على ستة إلكترونات ولكنها ستكون أكثر استقرارًا بثمانية إلكترونات، يلزم لذلك إلكترونان (واحد من كل ذرة هيدروجين). ومن ثم، فإن هذا يوضح أصل الصيغة المعروفة لجزيء الماء وهي H2O. يتشارك العنصران في الإلكترونات لملء الغلاف الخارجي لكل منهما، مما يجعل كلا العنصرين أكثر استقرارًا.
رابط تعليمي خارجي
شاهد هذا الفيديو القصير لمشاهدة رسم متحرك للترابط الأيوني والتساهمي:
الروابط التساهمية القطبية
هناك نوعان من الروابط التساهمية: الروابط التساهمية القطبية Polar covalent bond وغير القطبية. في الرابطة التساهمية القطبية، كما هي موضحة في الشكل 2.12، أن الذرات تشترك بشكل غير متساو في الإلكترونات وتنجذب إلى نواة واحدة أكثر من الأخرى. بسبب التوزيع غير المتكافئ للإلكترون بين ذرات العناصر المختلفة، تتطور شحنة موجبة قليلاً (δ+) أو سالبة قليلاً (δ-). هذه الشحنة الجزئية خاصية مهمة للمياه وتمثل العديد من خصائصها.
الماء جزيء قطبي، حيث تكتسب ذرات الهيدروجين شحنة موجبة جزئية والأكسجين شحنة سالبة جزئية. يحدث هذا لأن نواة ذرة الأكسجين أكثر جاذبية لإلكترونات ذرات الهيدروجين من جذب نواة الهيدروجين لإلكترونات الأكسجين. وبالتالي، فإن الأكسجين لديه طاقة كهربائية سالبة electronegativity أعلى من الهيدروجين، والإلكترونات المشتركة تقضي وقتًا بالقرب من نواة الأكسجين أكثر من الوقت الذي تقضيه بالقرب من نواة ذرات الهيدروجين، مما يعطي ذرات الأكسجين والهيدروجين شحنة سالبة وموجبة طفيفة، على الترتيب. هناك طريقة أخرى لتوضيح ذلك وهي أن احتمال العثور على إلكترون مشترك بالقرب من نواة الأكسجين يكون أكبر من احتمال العثور عليه بالقرب من نواة الهيدروجين. في كلتا الحالتين، تساهم الكهربية السالبة النسبية للذرة في تطوير شحنات جزئية عندما يكون أحد العناصر أكثر كهروسلبية بشكل ملحوظ من الآخر، ويمكن بعد ذلك استخدام الشحنات التي تولدها هذه الروابط القطبية لتكوين روابط هيدروجينية بناءً على جاذبية الشحنات الجزئية المعاكسة. (الروابط الهيدروجينية، التي نناقشها بالتفصيل أدناه، هي روابط ضعيفة بين ذرات الهيدروجين موجبة الشحنة إلى ذرات سالبة الشحنة في الجزيئات الأخرى). نظرًا لأن الجزيئات الكبيرة غالبًا ما تحتوي على ذرات تختلف في الكهربية، غالبًا ما توجد الروابط القطبية في الجزيئات العضوية.
الروابط التساهمية غير القطبية
تتشكل الروابط التساهمية غير القطبية بين ذرتين من نفس العنصر أو بين عناصر مختلفة تشترك في الإلكترونات بالتساوي. على سبيل المثال، الأكسجين الجزيئي (O2) غير قطبي لأن الإلكترونات توزع بالتساوي بين ذرتي الأكسجين.
يوضح الشكل 2.12 أيضًا مثالًا آخر على الرابطة التساهمية غير القطبية – غاز الميثان (CH4). يحتوي الكربون على أربعة إلكترونات في غلافه الخارجي ويحتاج إلى أربعة إلكترونات أخرى لملئه. تحصل على هذه الذرات الأربع من أربع ذرات هيدروجين، كل ذرة توفر واحد، مما يجعل لها غلافًا خارجيًا ثابتًا من ثمانية إلكترونات. لا يمتلك الكربون والهيدروجين نفس القدرة الكهربية ولكنهما متشابهان. وهكذا، تتشكل الروابط غير القطبية. تحتاج كل ذرات الهيدروجين إلى إلكترون واحد لغلافها الخارجي، والذي يتم ملؤه عندما يحتوي على إلكترونين. تشترك هذه العناصر في الإلكترونات بالتساوي بين ذرات الكربون والهيدروجين، مما يؤدي إلى تكوين جزيء تساهمي غير قطبي.
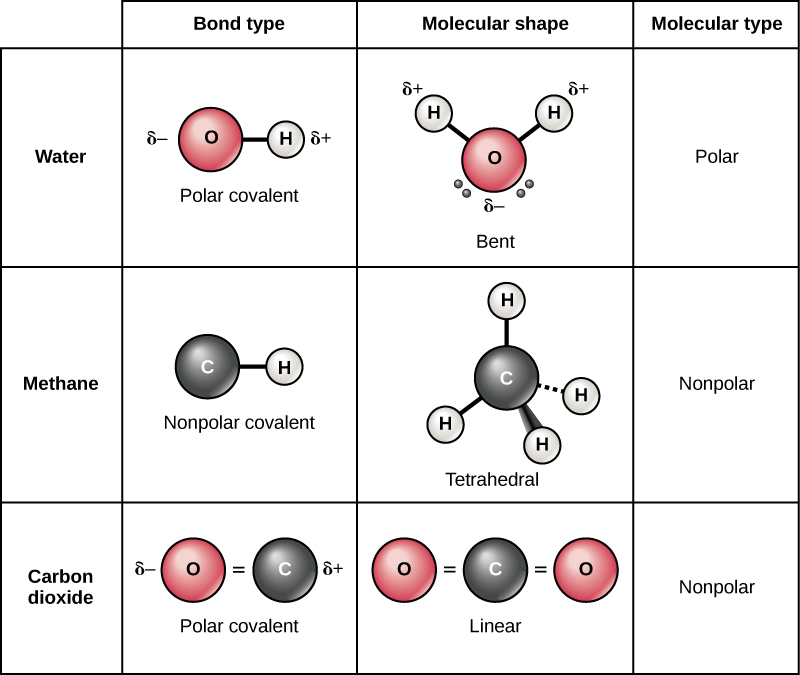
الشكل 2.12: يعتمد ما إذا كان الجزيء قطبيًا أو غير قطبي على نوع الرابطة والشكل الجزيئي. يحتوي كل من الماء وثاني أكسيد الكربون على روابط تساهمية قطبية، لكن ثاني أكسيد الكربون خطي، لذا فإن الشحنات الجزئية على الجزيء تلغي بعضها البعض.
روابط الهيدروجين وتفاعلات فان دير فال
تتطلب الروابط الأيونية والتساهمية بين العناصر طاقة لكسرها. الروابط الأيونية ليست قوية مثل التساهمية، والتي تحدد سلوكها في النظم البيولوجية. ومع ذلك، ليست كل الروابط عبارة عن روابط أيونية أو تساهمية. يمكن أن تتشكل الروابط الأضعف أيضًا بين الجزيئات. هناك رابطان ضعيفان يحدثان بشكل متكرر وهما الروابط الهيدروجينية وتفاعلات فان دير فال. بدون هذين النوعين من الروابط، لن تكون الحياة كما نعرفها موجودة. توفر الروابط الهيدروجينية العديد من الخصائص الهامة والمستدامة للحياة للمياه، كما تعمل على استقرار هياكل البروتينات والحمض النووي، وهو اللبنة الأساسية للخلايا.
عندما تحتوي الروابط التساهمية القطبية على شكل هيدروجين، يكون للهيدروجين الموجود في هذه الرابطة شحنة موجبة قليلاً لأن إلكترون الهيدروجين يتم سحبه بقوة أكبر تجاه العنصر الآخر وبعيدًا عن الهيدروجين. لأن الهيدروجين موجب قليلاً، فإنه سينجذب إلى الشحنات السالبة المجاورة. عندما يحدث هذا، يحدث تفاعل ضعيف بين شحنة الهيدروجين δ+ من جزيء واحد وشحنة الجزيء δ– على جزيء آخر مع الذرات الأكثر كهروسلبية، عادةً الأكسجين. يطلق العلماء على هذا التفاعل اسم رابطة هيدروجينية. هذا النوع من الروابط شائع ويحدث بانتظام بين جزيئات الماء. روابط الهيدروجين الفردية ضعيفة ويمكن كسرها بسهولة ؛ ومع ذلك، فإنها تحدث بأعداد كبيرة جدًا في الماء والبوليمرات العضوية، مما يخلق قوة رئيسية في التوليفة. الروابط الهيدروجينية مسؤولة أيضًا عن تجميع الحلزون المزدوج للحمض النووي معًا.
مثل روابط الهيدروجين، تعتبر تفاعلات فان دير فالس عوامل جذب ضعيفة أو تفاعلات بين الجزيئات. يمكن أن تحدث عوامل جذب Van der Waals بين أي جزيئين أو أكثر وتعتمد على التقلبات الطفيفة في كثافة الإلكترون، والتي لا تكون دائمًا متماثلة حول الذرة. لكي تحدث هذه التجاذبات، يجب أن تكون الجزيئات قريبة جدًا من بعضها البعض. تساهم هذه الروابط – جنبًا إلى جنب مع الروابط الأيونية والتساهمية والهيدروجينية – في البنية ثلاثية الأبعاد للبروتينات في خلايانا والتي تعد ضرورية لوظيفتها الصحيحة.
الاتصال الوظيفي: كيميائي صيدلاني
الكيميائيون الصيدلانيون مسؤولون عن تطوير عقاقير جديدة ومحاولة تحديد طريقة عمل كل من الأدوية القديمة والجديدة. يشاركون في كل خطوة من خطوات عملية تطوير الدواء. يمكننا أن نجد الأدوية في البيئة الطبيعية أو يمكننا تصنيعها في المختبر. في كثير من الحالات، يقوم الكيميائيون بتغيير الأدوية المحتملة من الطبيعة كيميائيًا في المختبر لجعلها أكثر أمانًا وفعالية، وأحيانًا تكون الإصدارات الاصطناعية من الأدوية بديلاً للإصدار الذي نجده في الطبيعة.
بعد الاكتشاف أو التوليف الأولي لدواء ما، يقوم الكيميائي بعد ذلك بتطوير العقار، وربما يغيره كيميائيًا، ويختبره لمعرفة ما إذا كان سامًا، ثم يصمم طرقًا لإنتاج فعال على نطاق واسع. بعد ذلك، تبدأ عملية الموافقة على العقار للاستخدام البشري. في الولايات المتحدة، تتولى إدارة الغذاء والدواء (FDA) الموافقة على الأدوية. يتضمن ذلك سلسلة من التجارب واسعة النطاق التي تستخدم البشر للتأكد من أن الدواء ليس ضارًا ويعالج بشكل فعال الحالة التي تم تصميمه من أجلها. غالبًا ما تستغرق هذه العملية عدة سنوات وتتطلب مشاركة الأطباء والعلماء، بالإضافة إلى الكيميائيين، لإكمال الاختبارات والحصول على الموافقة.
مثال على عقار تم اكتشافه في الأصل في كائن حي هو باكليتاكسيل (تاكسول)، وهو دواء مضاد للسرطان يستخدم لعلاج سرطان الثدي. تم اكتشاف هذا الدواء في لحاء شجرة الطقسوس في المحيط الهادئ. مثال آخر هو الأسبرين، المعزول في الأصل من لحاء شجرة الصفصاف. غالبًا ما يعني العثور على الأدوية اختبار مئات العينات من النباتات والفطريات وأشكال الحياة الأخرى لمعرفة ما إذا كانت تحتوي على أي مركبات نشطة بيولوجيًا. في بعض الأحيان، يمكن للطب التقليدي أن يعطي أدلة للطب الحديث حول مكان العثور على مركب نشط. على سبيل المثال، استخدم البشر لحاء الصفصاف في صناعة الأدوية منذ آلاف السنين، ويعود تاريخها إلى مصر القديمة. ومع ذلك، لم يتم حتى أواخر القرن التاسع عشر أن يقوم العلماء وشركات الأدوية بتنقية وتسويق جزيء الأسبرين، حمض أسيتيل الساليسيليك، للاستخدام البشري.
من حين لآخر، الأدوية التي يتم تطويرها لاستخدام واحد لها تأثيرات غير متوقعة تسمح باستخدامها بطرق أخرى غير ذات صلة. على سبيل المثال، طور العلماء في الأصل عقار مينوكسيديل (روجين) لعلاج ارتفاع ضغط الدم. عند اختباره على البشر، لاحظ الباحثون أن الأفراد الذين يتناولون الدواء سينمو لديهم شعرًا جديدًا. في النهاية، قامت شركة الأدوية بتسويق الدواء للأشخاص الذين يعانون من الصلع لاستعادة الشعر المفقود.
أخيرًا، قد يكتشف الكيميائي الصيدلاني آثارًا سلبية أو حتى نقصًا في التأثيرات. في أوائل الستينيات، ادعى المخترعون والأطباء وحتى عضو مجلس الشيوخ الأمريكي خصائص مضادة للسرطان لعقار جديد، كريبيوزين، وبدأوا في تسويقه وبيعه بقوة. من خلال عملية قياس الطيف بالأشعة تحت الحمراء، اكتشفت كيميائية إدارة الأغذية والعقاقير ألما ليفانت هايدن وفريقها أن “الدواء المعجزة” لم يكن أكثر من مركب شائع يسمى الكرياتين. قد تتضمن مهنة الكيميائي الصيدلاني العمل التحري والتجريب وتطوير الأدوية، وكل ذلك بهدف جعل البشر أكثر صحة.
المراجع
- موسوعة علم الأحياء، ترجمة وإعداد: د. م. مصطفى عبيد، مركز البحوث والدراسات متعدد التخصصات، إسطنبول، تركيا، 2022-2023.
- كتاب علم الأحياء، إصدار أوبنستاكس OpenStax، مقررات جامعة رايس، كبار المؤلفين المساهمين: ماري آن كلارك، جامعة تكساس ويسليان، ماثيو دوجلاس، كلية مجتمع غراند رابيدز، جونغ تشوي، معهد جورجيا للتكنولوجيا. تاريخ النشر 2018، آخر تحديث 2022، الترقيم المعياري الدولي للكتاب ISBN-13: 978-1-50669-985-1.