القياس في الكيمياء
بنهاية هذا القسم المخصص لموضوع القياس في الكيمياء سوف تكون قادرًا على:
- شرح ما هو القياس في الكيمياء وتحديد الأجزاء الأساسية الثلاثة للكمية
- وصف خصائص ووحدات الطول والكتلة والحجم والكثافة ودرجة الحرارة والزمن
- إجراء الحسابات والتحويلات الأساسية للوحدات في النظام المتري وأنظمة الوحدات الأخرى
المحتويات
توفر القياسات المعلومات الماكروسكوبية التي تشكل أساس معظم الفرضيات والنظريات والقوانين التي تصف سلوك المادة والطاقة في كل من المجالات الماكروسكوبية والميكروسكوبية للكيمياء. يوفر كل قياس ثلاثة أنواع من المعلومات: حجم أو مقدار القياس (عدد)؛ معيار المقارنة للقياس (وحدة)؛ وإشارة إلى عدم التأكد من القياس. بينما يتم تمثيل العدد والوحدة بشكل صريح عند كتابة الكمية، فإن عدم اليقين هو جانب من نتيجة القياس التي يتم تمثيلها ضمنيًا بشكل أكبر وسيتم مناقشتها لاحقًا.
يمكن تمثيل العدد في القياس بطرق مختلفة، بما في ذلك الشكل العشري والترميز العلمي. (يُعرف الترميز العلمي أيضًا بالتدوين الأسي).
على سبيل المثال، يبلغ الحد الأقصى لوزن الإقلاع لطائرة Boeing 777-200ER ما مقداره 298000 كيلوجرام، والتي يمكن كتابتها أيضًا على أنها 2.98 × 10 5 كجم. تبلغ كتلة البعوضة المتوسطة حوالي 0.0000025 كيلوجرام، والتي يمكن كتابتها على أنها 2.5 × 10−6 كجم.
وحدات القياس في الكيمياء
الوحدات، مثل اللترات والجنيه والسنتيمتر، هي معايير المقارنة للقياسات. عندما نشتري زجاجة من مشروب غازي بسعة 2 لتر، نتوقع أن حجم المشروب قد تم قياسه، لذا فهو أكبر بمرتين من الحجم الذي يوافق الجميع على أن يكون 1 لتر. يتم قياس اللحم المستخدم في تحضير همبورغر وزنه 0.25 رطل بحيث يزن ربع رطل، لذلك فهو يزن ربع ما يتم تحضيره باستخدام رطل من اللحم. بدون وحدات قياس، يمكن أن يكون العدد بلا معنى أو مربكًا أو ربما يهدد الحياة.
لنفترض أن الطبيب وصف الفينوباربيتال للتحكم في نوبات المريض وذكر جرعة “100” دون تحديد وحدات. لن يكون هذا مربكًا للأخصائي الطبي الذي يعطي الجرعة فحسب، بل يمكن أن تكون العواقب وخيمة: يمكن أن يكون تناول 100 مجم ثلاث مرات يوميًا فعالًا كمضاد للاختلاج، ولكن جرعة واحدة من 100 جرام تزيد عن 10 أضعاف الكمية المميتة.
نقوم عادةً بالإبلاغ عن نتائج القياسات العلمية في وحدات النظام الدولي SI، وهي نسخة محدثة من النظام المتري، باستخدام الوحدات المدرجة في الجدول 1.2. يمكن اشتقاق الوحدات الأخرى من هذه الوحدات الأساسية. تم تحديد معايير هذه الوحدات بموجب اتفاقية دولية، وتسمى النظام الدولي للوحدات أو وحدات SI (من الفرنسية، Le Système International d’Unités). تم استخدام وحدات SI من قِبل المعهد الوطني للمعايير والتكنولوجيا بالولايات المتحدة (NIST) منذ عام 1964.
| الخاصية التي يتم قياسها | اسم وحدة القياس | رمز وحدة القياس |
| الطول أو length | المتر أو meter | م |
| الكتلة أو mass | كيلوجرام أو Kilogram | كجم |
| الزمن أو time | ثانية أو second | ث |
| درجة الحرارة temperature | كلفن أو kelvin | ك |
| شدة التيار electric current | أمبير أو Ampere | أ |
| كمية المادة amount of substance | مول أو mol | مول |
| شدة الإضاءة luminous intensity | شمعة أو candle | شمعة |
أجزاء ومضاعفات وحدات القياس
نستخدم أحيانًا الوحدات التي تكون كسورًا أو مضاعفات من الوحدة الأساسية. يُباع الآيس كريم في كوارت (وحدة أساسية مألوفة لا تتبع النظام الدولي للوحدات)، أو مكاييل (0.5 لتر)، أو جالون (4 ليترات). نستخدم أيضًا الكسور أو مضاعفات الوحدات في نظام SI، ولكن هذه الكسور أو المضاعفات دائمًا ما تكون قوى من 10. يتم تسمية وحدات SI الكسرية أو المتعددة باستخدام بادئة واسم الوحدة الأساسية. على سبيل المثال، يُطلق على طول 1000 متر أيضًا اسم كيلومتر لأن البادئة كيلو تعني “ألف”، والتي في التدوين العلمي هي 10 3 (1 كيلومتر = 1000 م = 10 3 م). فيما يلي يتم سرد البادئات المستخدمة والقوى التي تم رفع 10 إليها في الجدول 1.3.
| البادئة | الرمز | المعامل | مثال توضيحي |
| فيمتو | f | 10 -15 | 1 femtosecond (fs) = 1 × 10−15 m (0.000000000000001 s) |
| بيكو | p | 10 -12 | 1 picometer (pm) = 1 × 10−12 m (0.000000000001 m) |
| نانو | n | 10 -9 | 4 nanograms (ng) = 4 × 10−9 g (0.000000004 g) |
| ميكرو | m | 10 -6 | 1 microliter (μL) = 1 × 10−6 L (0.000001 L) |
| مللي | m | 10 -3 | 2 millimoles (mmol) = 2 × 10−3 mol (0.002 mol) |
| سنم | c | 10 -2 | 7 centimeters (cm) = 7 × 10−2 m (0.07 m) |
| ديسي | d | 10 -1 | 1 deciliter (dL) = 1 × 10−1 L (0.1 L ) |
| كيلو | k | 10 3 | 1 kilometer (km) = 1 × 103 m (1000 m) |
| ميجا | M | 10 6 | 3 megahertz (MHz) = 3 × 106 Hz (3,000,000 Hz) |
| جيجا | G | 10 9 | 8 gigayears (Gyr) = 8 × 109 yr (8,000,000,000 Gyr) |
| تيرا | T | 10 12 | 5 terawatts (TW) = 5 × 1012 W (5,000,000,000,000 W) |
الوحدات الأساسية في النظام الدولي للوحدات
تم إنشاء الوحدات الأساسية للنظام المتري، والتي تطورت في النهاية إلى نظام الوحدات الدولي SI، في فرنسا خلال الثورة الفرنسية. تم اعتماد المعايير الأصلية للمتر والكيلوغرام هناك في عام 1799 وفي النهاية من قبل دول أخرى. يقدم هذا القسم أربع وحدات أساسية من النظام الدولي للوحدات المستخدمة بشكل شائع في الكيمياء. سيتم تقديم وحدات النظام الدولي الأخرى في الفصول اللاحقة.
وحدات قياس الطول
وحدة الطول القياسية في كل من SI والأنظمة المترية الأصلية هي المتر (م). تم تحديد المتر في الأصل على أنه 1 / 10،000،000 من المسافة من القطب الشمالي إلى خط الاستواء. يتم تعريفه الآن على أنه المسافة التي ينتقلها الضوء في الفراغ في 1 / 299،792،458 من الثانية. المتر أطول بحوالي 3 بوصات من الياردة (الشكل 1.23)؛ المتر الواحد حوالي 39.37 بوصة أو 1.094 ياردة. غالبًا ما يتم التقرير عن المسافات الأطول بالكيلومترات (1 كم = 1000 م = 10 3 م) ، في حين يمكن التقرير عن المسافات الأقصر بالسنتيمتر (1 سم = 0.01 م = 10−2 م) أو المليمترات (1 مم = 0.001 م = 10−3 م).
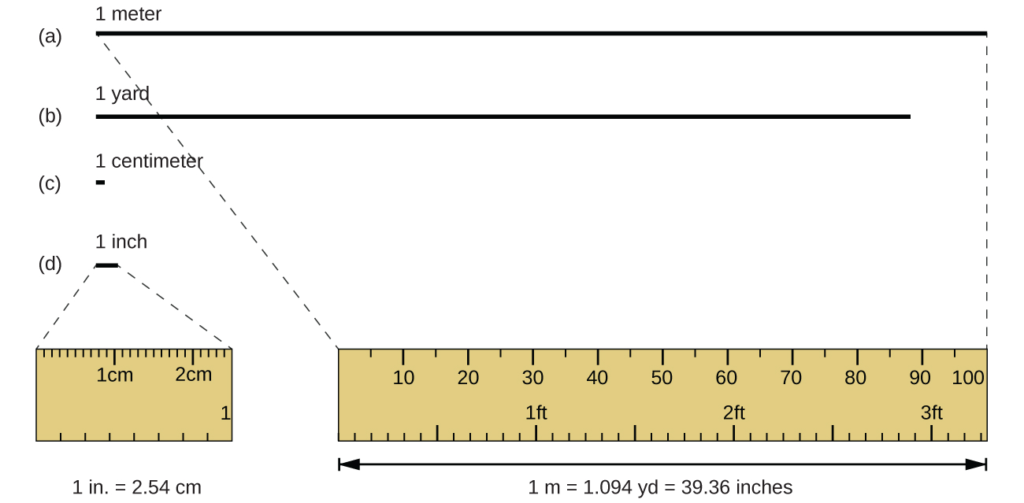
الشكل 1.23: الأطوال النسبية 1 م، 1 ياردة، 1 سم، 1 بوصة موضحة (ليس الطول الفعلي)، بالإضافة إلى مقارنات 2.54 سم و1 بوصة، و 1 م و1.094 ياردة.
وحدات قياس الكتلة
الوحدة القياسية للكتلة في النظام الدولي للوحدات هي الكيلوجرام (كجم). تم تعريف الكيلوجرام في الأصل على أنه كتلة لتر من الماء (مكعب من الماء بطول 0.1 متر بالضبط). يتم تعريفه الآن بواسطة أسطوانة معينة من سبيكة البلاتين-إيريديوم، والتي يتم الاحتفاظ بها في فرنسا (الشكل 1.24). يقال إن أي جسم له نفس كتلة هذه الأسطوانة كتلته 1 كيلوجرام. كيلوغرام واحد يساوي حوالي 2.2 رطل. الجرام (جم) يساوي بالضبط 1/1000 من كتلة الكيلوجرام (10−3 كجم).

الشكل 1.24: يوجد النموذج الأولي للكيلوجرام هذا في المعهد الوطني للمعايير والتكنولوجيا (NIST) في ولاية ماريلاند. (المصدر: المعاهد الوطنية للمعايير والتكنولوجيا).
وحدات قياس درجة الحرارة
درجة الحرارة خاصية مكثّفة. وحدة درجة الحرارة في النظام الدولي للوحدات هي كلفن (K). تقضي اتفاقية IUPAC باستخدام كلفن kelvin (كلها أحرف صغيرة) للكلمة، K (أحرف كبيرة) لرمز الوحدة، ولكن لا تستخدم كلمة “درجة” ولا رمز الدرجة (°). يُسمح أيضًا بالدرجة المئوية (° C) في نظام SI، مع استخدام كل من كلمة “درجة” ورمز الدرجة المستخدمة في القياسات المئوية. الدرجات السلزية Celsius هي نفس درجة كلفن، لكن المقياسين يضعان أصفارهما في أماكن مختلفة. يتجمد الماء عند 273.15 كلفن (صفر درجة مئوية) ويغلي عند 373.15 كلفن (100 درجة مئوية) بحكم التعريف، ودرجة حرارة جسم الإنسان الطبيعية حوالي 310 كلفن (37 درجة مئوية). ستتم مناقشة التحويل بين هاتين الوحدتين ومقياس فهرنهايت لاحقًا في هذا الفصل.
وحدات قياس الزمن
وحدة الزمن الأساسية للنظام الدولي للوحدات هي الثانية (Second). يمكن التعبير عن الفترات الزمنية الصغيرة والكبيرة بالبادئات المناسبة؛ على سبيل المثال، 3 ميكروثانية = 0.000003 ثانية = 3 × 10−6 و5 ميجا ثانية = 5،000،000 ثانية = 5 × 10 6 ثانية. بدلاً من ذلك، يمكن استخدام الساعات والأيام والسنوات.
وحدات النظام الدولي المشتقة
يمكننا اشتقاق العديد من الوحدات من الوحدات السبع الأساسية للنظام الدولي للوحدات. على سبيل المثال، يمكننا استخدام وحدة الطول الأساسية لتحديد وحدة الحجم Volume، ويمكن استخدام الوحدات الأساسية للكتلة والطول لتحديد وحدة الكثافة.
الحجم
الحجم هو قياس مقدار الحيّز التي يشغله كائن. يتم تحديد وحدة الحجم القياسية في النظام الدولي للوحدات من خلال وحدة الطول الأساسية (الشكل 1.25). الحجم القياسي هو متر مكعب (م 3)، مكعب طول حرفه متر واحد بالضبط. لتوزيع متر مكعب من الماء، يمكننا بناء صندوق مكعب بطول متر واحد بالضبط. يحتوي هذا الصندوق على متر مكعب من الماء أو أي مادة أخرى.
يتم اشتقاق وحدة الحجم الأكثر شيوعًا من الديسيمتر (0.1 م ، أو 10 سم). مكعب بطول حرف واحد بالضبط ديسيمتر يحتوي على حجم واحد ديسيمتر مكعب (dm3). اللتر (L) هو الاسم الأكثر شيوعًا للديسيمتر المكعب. كما أن لتر واحد حوالي 1.06 ليتر.
السنتيمتر المكعب سم3 (cm3) هو حجم مكعب طول حرفه سنتيمتر واحد بالضبط. غالبًا ما يستخدم الاختصار cc (للسنتيمتر المكعب) من قبل المتخصصين الصحيين. يُطلق على السنتيمتر المكعب أيضًا المليلتر (ملل) وهو 1/1000 من اللتر.
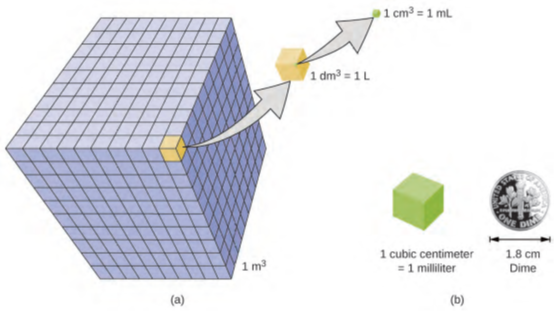
الشكل 1.25: (أ) يتم عرض الأحجام النسبية للمكعبات التي يبلغ حجمها 1 م 3 و1 دسم 3 (1 لتر) و1 سم 3 (1 ملل) (ولكن هذا ليس مقياسًا). (ب) يُقارن قطر الدايم بالنسبة لطول حافة مكعب بحجم 1 سم 3 (1 ملل).
الكثافة
نستخدم كتلة وحجم المادة لتحديد كثافتها. وبالتالي، يتم تحديد وحدات الكثافة من خلال الوحدات الأساسية للكتلة والطول.
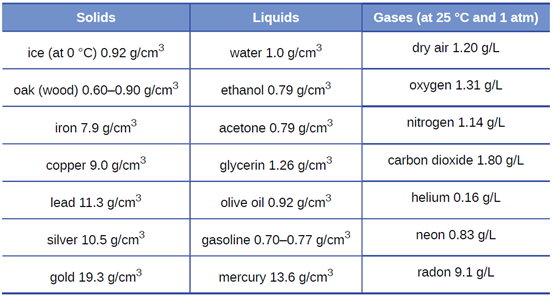
كثافة المادة هي نسبة كتلة عينة من المادة إلى حجمها. وحدة SI للكثافة هي كيلوغرام لكل متر مكعب (كجم / م3) أو (kg / m3). ومع ذلك، في كثير من الحالات، يتم استخدام هذا كوحدة غير ملائمة، وغالبًا ما نستخدم جرامًا لكل سنتيمتر مكعب (جم / سم 3) لكثافة المواد الصلبة والسوائل، وجرامًا لكل لتر (جم / لتر) للغازات.
على الرغم من وجود استثناءات، فإن معظم السوائل والمواد الصلبة لها كثافة تتراوح من حوالي 0.7 جم / سم 3 (كثافة البنزين) إلى 19 جم / سم 3 (كثافة الذهب). كثافة الهواء حوالي 1.2 جم / لتر. يوضح الجدول 1.4 كثافات بعض المواد الشائعة.
في حين أن هناك العديد من الطرق لتحديد كثافة جسم ما، ربما تتضمن الطريقة الأكثر وضوحًا إيجاد كتلة وحجم الجسم بشكل منفصل، ثم قسمة كتلة العينة على حجمها. في المثال التالي، تُحسب الكتلة مباشرة عن طريق الوزن، لكن الحجم يُحسب بشكل غير مباشر من خلال قياسات الطول.
الكثافة = الكتلة / الحجم
أمثلة ومسائل على القياس في الكيمياء
مثال 1.1: الكشف عن الذهب باستخدام حساب الكثافة
كان الذهب – في شكل قوالب، وقطع، وعملات معدنية – شكلاً من أشكال العملات لعدة قرون. من أجل خداع الناس لدفع ثمن سبائك الذهب ولكن دون الاستثمار الفعلي في سبيكة من الذهب، فكر الناس في ملء مراكز السبيكة الذهبية المجوف بالرصاص لخداع المشترين للاعتقاد بأن السبيكة بأكملها من الذهب. وهذا الأمر لا يعمل: لأن الرصاص مادة كثيفة، لكن كثافته ليست بنفس كثافة الذهب، 19.3 جم / سم 3. ما كثافة الرصاص إذا كان طول حرف مكعب من الرصاص 2.00 سم وكتلته 90.7 جم؟
الحل:
يمكن حساب كثافة المادة بقسمة كتلتها على حجمها. يتم حساب حجم المكعب عن طريق تكعيب طول الحافة.
حجم مكعب الرصاص = 2.00 سم × 2.00 سم × 2.00 سم = 8.00 سم 3
الكثافة = الكتلة / الحجم = 90.7 جم / 8.00 سم3 = 11.3 جم / 1.00 سم3 = 11.3 جم / سم3
(سوف نناقش سبب التقريب إلى أول منزلة عشرية في القسم التالي).
تحقق من فهمك:
- لأقرب ثلاث منازل عشرية، ما هو حجم المكعب (سم 3) الذي طول حرفه 0.843 سم؟
- إذا كان المكعب الموجود في الجزء (أ) نحاسًا وكتلته 5.34 جم، فما كثافة النحاس لأقرب منزلتين عشريتين؟
الجواب: (أ) 0.599 سم3؛ (ب) 8.91 جم / سم3
رابط تعليمي خارجي
لمعرفة المزيد حول العلاقة بين الكتلة والحجم والكثافة، استخدم الرابط التالي للانتقال إلى برنامج المُحاكاة التفاعلي، لاستكشاف كثافة المواد المختلفة، مثل الخشب والجليد والطوب والألمنيوم ومقارنتها. https://www.simbucket.com/density/
مثال 1.2: استخدام إزاحة الماء لتحديد الكثافة
يوضح برنامج محاكاة الكثافة التفاعلي أعلاه طريقة أخرى لتحديد الكثافة باستخدام إزاحة الماء. ثم حدد كثافة المربعات الحمراء والصفراء.
الحل:
عند فتح برنامج محاكاة الكثافة التفاعلي وتحديد نفس الكتلة، يمكنك الاختيار من بين عدة كتل ملونة بوزن 5.00 كجم يمكنك إسقاطها في خزان يحتوي على 100.00 لتر من الماء. الكتلة الصفراء تطفو (وهي أقل كثافة من الماء)، ويرتفع منسوب المياه إلى 105.00 لتر. أثناء الطفو، تزيح الكتلة الصفراء 5.00 لترات من الماء، وهي كمية مساوية لوزن الكتلة. تغرق الكتلة الحمراء (وهي أكثر كثافة من الماء، حيث كثافته = 1.00 كجم / لتر)، ويرتفع منسوب المياه إلى 101.25 لتر. وبالتالي فإن الكتلة الحمراء تزيح 1.25 لتر من الماء، وهي كمية مساوية لحجم الكتلة، كثافة الكتلة الحمراء:
الكثافة = الكتلة / الحجم = 5.00 كجم / 1.25 لتر = 4.00 كجم / لتر
لاحظ أنه نظرًا لأن الكتلة الصفراء ليست مغمورة بالكامل، فلا يمكنك تحديد كثافتها من هذه المعلومات. ولكن إذا كنت تمسك الكتلة الصفراء في أسفل الخزان، فإن منسوب المياه يرتفع إلى 110.00 لترًا، مما يعني أنه يزيح الآن 10.00 لترًا من الماء، ويمكن العثور على كثافتها كما يلي:
الكثافة = الكتلة / الحجم = 5.00 كجم / 10.00 لتر = 0.500 كجم / لتر
تحقق من فهمك لموضوع القياس في الكيمياء:
قم بإزالة كل الكتل من الماء وأضف الكتلة الخضراء إلى خزان الماء، وضعها في منتصف الخزان تقريبًا. ثم حدد كثافة الكتلة الخضراء.
الجواب: 2.00 كجم / لتر.
المراجع
- مقرر الكيمياء، كلية OpenStax، تاريخ النشر OpenStax College, Chemistry ،11 March 2015. الفصل الأول، الأفكار والمفاهيم الأساسية في الكيمياء.
- موسوعة الكيمياء من الألف إلى الياء، ترجمة وإعداد: د. م. مصطفى عبيد، مركز البحوث والدراسات متعدد التخصصات، إسطنبول، 2022-2023.